
| A. | 为延长食品保质期,可向其中大量添加苯甲酸钠等防腐剂 | |
| B. | 催化转化机动车尾气为无害气体,能消除酸雨和雾霾的发生 | |
| C. | PM2.5是指空气中氮氧化物和硫氧化物含量之和 | |
| D. | 以树皮和麻绳为原料所造的纸张其主要成分是纤维素,但纤维素与淀粉不是同分异构体 |
分析 A.过量的防腐剂会损害人体的健康;
B.催化转化机动车尾气为无害气体,只能减少酸雨和雾霾的发生,不可能消除;
C.PM2.5是指空气中直径≤2.5μm的颗粒物;
D.分子式相同结构不同的有机物互为同分异构体.
解答 解:A.过量的食品防腐剂会危害人体健康,故A错误;
B.催化转化机动车尾气为无害气体,只能减少酸雨和雾霾的发生,不可能消除,故B错误;
C.PM2.5是指空气中直径≤2.5μm的颗粒物,不是指空气中氮氧化物和硫氧化物含量之和,故C错误;
D.淀粉和纤维素的表达式虽然相同,但是聚合度n值不同,故分子式不同,二者不互为同分异构体,故D正确;
故选:D.
点评 本题考查了常见食品添加剂、生活中常见的环境污染与治理,熟悉相关物质的性质是解题关键,注意酸雨的成因、pM2.5的概念,题目难度不大.


 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案科目:高中化学 来源: 题型:选择题
| A. | Na+ OH- SO42- HCO3- | B. | OH- NH4+ SO42- Ba2+ | ||
| C. | Fe2+ H+ SO42- NO3- | D. | H+ K+ Cl- HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4 | B. | C2H5OH | C. | CH3CHO | D. | CH3COOH |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
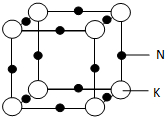 2015年8月12号接近午夜时分,天津滨海新区一处集装箱码头发生爆炸.发生爆炸的是集装箱内的易燃易爆物品,爆炸火光震天,并产生巨大蘑菇云.根据掌握的信息分析,装箱区的危险化学品可能有钾、钠、氯酸钠、硝酸钾、烧碱,硫化碱、硅化钙、三氯乙烯、氯碘酸等.运抵区的危险化学品可能有环己胺、二甲基二硫、甲酸、硝酸铵、氰化钠、4,6-二硝基苯-邻仲丁基苯酚等.
2015年8月12号接近午夜时分,天津滨海新区一处集装箱码头发生爆炸.发生爆炸的是集装箱内的易燃易爆物品,爆炸火光震天,并产生巨大蘑菇云.根据掌握的信息分析,装箱区的危险化学品可能有钾、钠、氯酸钠、硝酸钾、烧碱,硫化碱、硅化钙、三氯乙烯、氯碘酸等.运抵区的危险化学品可能有环己胺、二甲基二硫、甲酸、硝酸铵、氰化钠、4,6-二硝基苯-邻仲丁基苯酚等.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
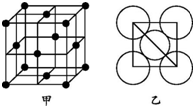 铜、铁、铝都是日常生活中常见的金属,具有广泛用途.请回答:
铜、铁、铝都是日常生活中常见的金属,具有广泛用途.请回答:查看答案和解析>>
科目:高中化学 来源: 题型:推断题
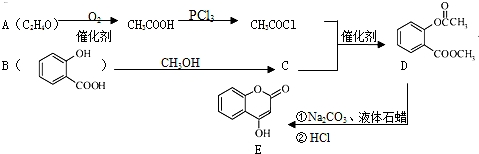
 .
. .
.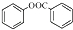 )是一种重要的有机合成中间体.试写出以苯、甲苯为原料制取该化合物的合成路线流程图(无机原料任选).合成路线流程图示例如下:
)是一种重要的有机合成中间体.试写出以苯、甲苯为原料制取该化合物的合成路线流程图(无机原料任选).合成路线流程图示例如下:查看答案和解析>>
科目:高中化学 来源: 题型:推断题
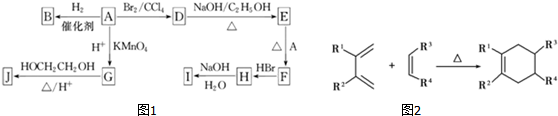
 .
. .
. .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 分子式为C7H16的烷烃,含有3个甲基的同分异构体有2种 | |
| B. | 分子式为C7H12O4,其中只含二个-COOCH3基团的同分异构体(不考虑手性异构)共有4种 | |
| C. | 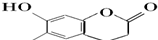 芥子醇的结构简式如图该分子中有5种官能团 芥子醇的结构简式如图该分子中有5种官能团 | |
| D. | 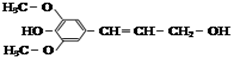 化合物如图能使酸性高锰酸钾溶液褪色,且1mol最多可与4mol氢气发生反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
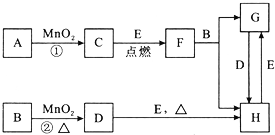
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com