
 某同学为测定维生素C中碳、氢的质量分数,取维生素C样品研碎,称取该试样3.52克置于铂舟并放入燃烧管中,不断通入氧气流.用酒精喷灯持续加热样品,将生成物先后通过无水硫酸铜和碱石灰,两者分别增重1.44克和5.28克,生成物完全被吸收.试回答以下问题:
某同学为测定维生素C中碳、氢的质量分数,取维生素C样品研碎,称取该试样3.52克置于铂舟并放入燃烧管中,不断通入氧气流.用酒精喷灯持续加热样品,将生成物先后通过无水硫酸铜和碱石灰,两者分别增重1.44克和5.28克,生成物完全被吸收.试回答以下问题:| 12 |
| 44 |
| 2 |
| 18 |


 全优冲刺100分系列答案
全优冲刺100分系列答案 英才点津系列答案
英才点津系列答案科目:高中化学 来源: 题型:
| A、1L 0.3mol/L Na2SO4溶液 |
| B、4L 0.5mol/L NaCl溶液 |
| C、5L 0.4mol/L NaOH |
| D、2L 0.15mol/L Na3PO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、食品中的苯甲酸钠是防腐剂 |
| B、火腿中的亚硝酸钠是发色剂 |
| C、饮料中的柠檬酸是发泡剂 |
| D、豆腐中的硫酸钙是防腐剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
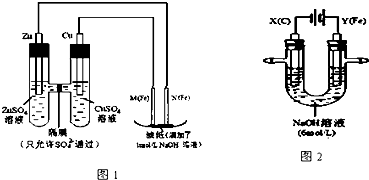
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
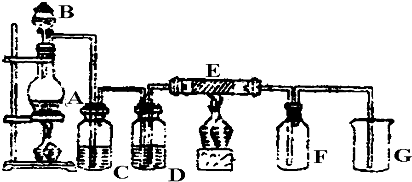
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com