
| n |
| V |


科目:高中化学 来源: 题型:
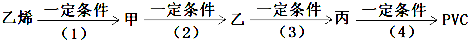
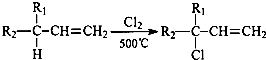
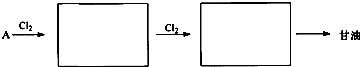
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2 | B、3 | C、4 | D、5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素编号 | 元素性质或原子结构 |
| T | 单质能与水剧烈反应,所得溶液呈弱酸性 |
| X | L层p电子数比s电子数多2个 |
| Y | 第3周期元素的简单离子中半径最小 |
| Z | L层有三个未成对电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
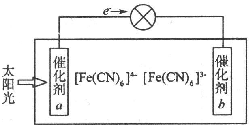 铁、铜等金属及其化合物在日常生活中应用广泛,回答下列问题.
铁、铜等金属及其化合物在日常生活中应用广泛,回答下列问题.
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
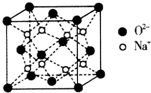 H、C、N、O、Na、Fe、Cu是常见的七种元素.
H、C、N、O、Na、Fe、Cu是常见的七种元素.查看答案和解析>>
科目:高中化学 来源: 题型:
45 26 |
45 26 |
| A、它是一种新元素 | ||||
B、
| ||||
| C、它是一种新核素 | ||||
D、这种铁原子发生衰变放出两个质子后变成
|
查看答案和解析>>
科目:高中化学 来源: 题型:
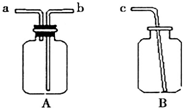 化学是一门以实验为基础的科学.
化学是一门以实验为基础的科学.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、新制氯水显酸性,向其中滴加少量紫色石蕊试液,充分振荡后溶液呈红色 |
| B、加水稀释溶液,溶液中的所有离子浓度都减小 |
| C、金属铝的生产是以Al2O3为原料,在熔融状态下进行电解 |
| D、NaHCO3溶液中含有少量Na2CO3可以用澄清石灰水除去 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com