
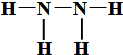
分析 (1)根据焓变等于反应物键能之和-生成物键能之和计算;
(2)①$\frac{1}{2}$N2(g)+O2(g)═NO2(g)△H1=+33.6kJ/mol
②N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=-543kJ•mol-1
依据盖斯定律②×2-①×2计算得到.
解答 解:(1)在反应N2H4(g)+O2(g)═N2(g)+2H2O(l)△H2=-534kJ/mol,设N2H4(肼)中N-N的键的键能为xkJ/mol,则根据焓变等于反应物键能之和-生成物键能之和,所以△H2=-534kJ/mol=391×4+x+495-946-463×4,解得x=205kJ/mol
故答案为:205;
(2)①$\frac{1}{2}$N2(g)+O2(g)═NO2(g)△H1=+33.6kJ/mol
②N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=-543kJ•mol-1
依据盖斯定律②×2-①×2得到,2N2H4(g)+2NO2(g)=3N2(g)+4H2O (g)△H=-543×2-33.6×2=-1153.2kJ•mol-1;
故答案为:2N2H4(g)+2NO2(g)=3N2(g)+4H2O (g)△H=-1153.2kJ•mol-1 .
点评 本题考查了热化学方程式的计算和盖斯定律的计算应用,理解实质,掌握基础是解题关键,题目较简单.


科目:高中化学 来源: 题型:多选题
| A. | FeCl3溶液与Cu粉反应:Cu+2Fe3+═Cu2++2Fe2+ | |
| B. | 钠与水反应:Na+2H2O=Na++2OH-+H2↑ | |
| C. | 氯气与水反应:Cl2+H2O?2H++Cl-+ClO- | |
| D. | 氯化铝溶液与过量氨水反应:3NH3•H2O+Al3+=Al(OH)3↓+3NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某研究性学习小组设计了一组实验,验证元素周期律.
某研究性学习小组设计了一组实验,验证元素周期律.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
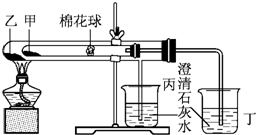 下列是某兴趣小组根据课本实验设计的一个能说明碳酸钠与碳酸氢钠热稳定性的套管实验.请观察下图的实验装置,分析实验原理,回答下列问题:
下列是某兴趣小组根据课本实验设计的一个能说明碳酸钠与碳酸氢钠热稳定性的套管实验.请观察下图的实验装置,分析实验原理,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4分子的比例模型: | B. | 氯原子的结构示意图: | ||
| C. | NH3分子的电子式: | D. | CO2分子的结构式:O=C=O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 实验室需要0.1mol/LNaOH溶液450mL和0.5mol/L的硫酸溶液500mL.根据这两种溶液的配制情况回答下列问题.
实验室需要0.1mol/LNaOH溶液450mL和0.5mol/L的硫酸溶液500mL.根据这两种溶液的配制情况回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含有NA个氦原子的氦气在标准状况下的体积约为11.2L | |
| B. | 标准状况下,9克H2O 含有的分子数为0.5NA | |
| C. | 常温常压下,32g O2和O3的混合气体所含原子数为2NA | |
| D. | 1mol Fe和足量稀盐酸反应,铁失去的电子数为2NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com