
| ||
| ||


 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 2SO2(g)+O2(g)
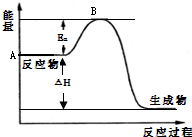
2SO2(g)+O2(g)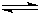 2SO3(g)△H=a kJ?mol-1,反应过程的能量变化如图所示.已知1mol SO2(g)完全转化为1mol SO3(g)放热99kJ.请回答:
2SO3(g)△H=a kJ?mol-1,反应过程的能量变化如图所示.已知1mol SO2(g)完全转化为1mol SO3(g)放热99kJ.请回答:查看答案和解析>>
科目:高中化学 来源:2015届福建省等五校高二上学期期中考试化学试卷(解析版) 题型:填空题
2SO2(g)+ O2(g)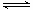 2SO3(g) △H = a kJ·mol-1,反应过程的能量变化如图所示。已知1mol
SO2(g)完全转化为1mol SO3(g)放热99 kJ。请回答:
2SO3(g) △H = a kJ·mol-1,反应过程的能量变化如图所示。已知1mol
SO2(g)完全转化为1mol SO3(g)放热99 kJ。请回答:
(1)图中A点表示_______________________,a=__________ 。
(2) Ea的大小对该反应的△H _______(填“有” 或“无”)影响。该反应常用V2O5作催化剂,加入V2O5会使图中B点_________(填“升高”、“降低”或“不变”)。
(3)已知单质硫的标准燃烧热为296kJ·mol-1,写出反应的热化学方程式:________________________ ____,常温常压下,由单质硫和氧气经两步反应,若生成1mol SO3(g),放出的总热量为___ ___ 。
查看答案和解析>>
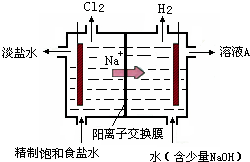
科目:高中化学 来源:2013-2014学年江西省高三第四次模考化学试卷(解析版) 题型:填空题
含氯消毒剂和过氧化物等强氧化性消毒剂可防甲型H1N1流感。
(1)过碳酸钠是一种有多种用途的新型氧系固态漂白剂,化学式可表示为Na2CO3·3H2O2,它具有Na2CO3和H2O2的双重性质。
①H2O2有时可作为矿业废液消毒剂,如消除采矿业废液中的氰化物(如NaCN),经以下反应实现:NaCN+H2O2+H2O=A+NH3↑,则生成物A的化学式______________
②某强酸性反应体系中,反应物和生成物共六种物质:
O2、MnO4-、H2O、Mn2+、H2O2、H+。已知该反应中H2O2只发生了如下过程:H2O2→ O2。
写出该反应的离子方程式:_______________________________________________。
(2)某天然碱的化学式可表示为:aNa2CO3·bNaHCO3·2H2O,取m g天然碱溶于水配成溶液,再向溶液中逐滴加入1 mol/L的盐酸,标准状况下产生的CO2的体积与所加盐酸体积之间的关系某同学作出了如图所示的A和B曲线,试回答下列问题:
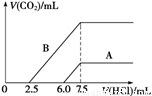
①_______曲线正确,天然碱的化学式为___________,
②加盐酸后产生CO2气体体积(标准状况)的最大值为 _____________mL。
(3) 常温下用氧缺位铁酸锌ZnFe2Oy可以消除NOx污染,使NOx转变为N2,同时ZnFe2Oy转变为ZnFe2O4。若2 mol ZnFe2Oy与足量NO2可生成0.5 mol N2,则y=_______________。
查看答案和解析>>
科目:高中化学 来源:2015届四川省雅安市高一下学期期末检测化学试卷(解析版) 题型:填空题
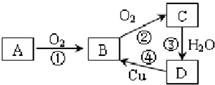
已知A经如右图所示的过程转化为D, 
请回答下列问题:
(1)若A为非金属单质,且常温下为淡黄色固体,B为刺激性气味的无色气体,能使品红溶液褪色,D为强酸。
①D的化学式是 。
②在工业生产中B气体的大量排放被雨水吸收后形成了 而污染了环境。某工厂净化残余的B气体装置如图,则除去B气体的总反应方程式是 。
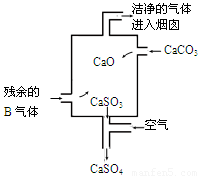
(2)若A是能使酚酞试液变红的气体。D是一种强酸。写出A→B的化学方程式 ;工业生产上,以34吨A为原料,最多可以生产63%的D酸 吨。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com