

A.原子半径的大小顺序为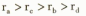 |
| B.元素e、f的氢化物中,f的氢化物较稳定 |
| C.八种元素的单质中,常温下有五种固体 |
| D.c、d、f、h的最高价氧化物对应的水化物的酸性依次增 |
 百年学典课时学练测系列答案
百年学典课时学练测系列答案科目:高中化学 来源:不详 题型:单选题
| A.Na+ < Mg2+ < Al3+ < F- | B.S2-< Cl-< Na+ < Al3+ |
| C.Na > Mg > Al > S | D.Cs < Rb < K < Na |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 代号 | 物质 | 结构简式 | 水中溶解度/g (25℃) | 熔点/℃ | 沸点/℃ |
| A | 邻—硝基苯酚 | 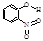 | 0.2 | 45 | 100 |
| B | 对—硝基苯酚 | 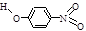 | 1.7 | 114 | 295 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 编号 | 性质 | 化学方程式 |
| 示例 | 氧化性 | H2WO3+3H3PO3===3H3PO4+H2W↑ |
| 1 | | |
| 2 | | |

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
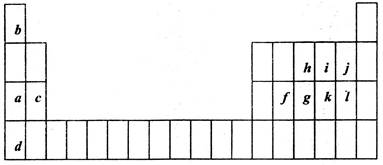
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.元素X和Y可以形成两种以上的气态化合物 |
| B.原子半径的大小顺序为:r(Z)>r(M)>r(R) |
| C.元素的最高价氧化物对应水化物的酸性R强于M |
| D.加热蒸干由元素B和Z形成的化合物的水溶液可以得到该化合物的晶体 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 物有:AsH3、H2SO4、KBrO3、K2SO4、H3AsO4、H2O和一种未知物质X。
物有:AsH3、H2SO4、KBrO3、K2SO4、H3AsO4、H2O和一种未知物质X。 。(填序号)
。(填序号)| A.氧化性:KBrO3>H3AsO4 | B.氧化性:H3AsO4> KBrO3 KBrO3 |
| C.还原性:AsH3>X | D.还原性:X>AsH3 |

 物能分解为它的另一种氢化物,此分解反应的化学方程式是 。
物能分解为它的另一种氢化物,此分解反应的化学方程式是 。
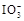 +5I-+6H+=3I2+3H2O,据此反应,可用试纸和一些生活中常见的物质设计实验,证明食盐中存在
+5I-+6H+=3I2+3H2O,据此反应,可用试纸和一些生活中常见的物质设计实验,证明食盐中存在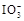 。可供选用的物质有:①自来水;②蓝色石蕊试纸;③碘化钾淀粉试纸;④淀粉;⑤食醋;⑥白酒;⑦食糖。你认为进行上述实验时必须使用的物质是 (填序号)。
。可供选用的物质有:①自来水;②蓝色石蕊试纸;③碘化钾淀粉试纸;④淀粉;⑤食醋;⑥白酒;⑦食糖。你认为进行上述实验时必须使用的物质是 (填序号)。查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 电子式为 ;反应③中被破坏的化学键属
电子式为 ;反应③中被破坏的化学键属 于 键(填“极性”或“非极性”)。
于 键(填“极性”或“非极性”)。 位于周期表的第
位于周期表的第  周期 族。
周期 族。 3)卤素单质及化
3)卤素单质及化 合物在许多性质上都存在着递变规律。下列有关说法正确的是 。
合物在许多性质上都存在着递变规律。下列有关说法正确的是 。 氢的还原性按HF、HCl、HBr、HI的顺序依次减弱
氢的还原性按HF、HCl、HBr、HI的顺序依次减弱查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com