
在反应3Cl2+6NaOH=NaClO3+5NaCl+3H2O中,当有m g C l2被氧化时,被还原的氯气是( )。
l2被氧化时,被还原的氯气是( )。
A.3m g B. 5m g C. 6m/35.5 mol D. 5m/71 mol
科目:高中化学 来源: 题型:
(1)用50mL 0.50mol·L-1盐酸与50mL 0.55mol·L-1NaOH溶液在如下图所示的装置中进行中和反应。通过测定反应过程中放出的热量可计算中和热。回答下列问题:
 ①烧杯间填满碎泡沫塑料的作用是 。
①烧杯间填满碎泡沫塑料的作用是 。
②若大烧杯上改为盖薄铁板,求得的反应热数值:
(填“偏大”、“偏小”或“无影响”)
③若通过测定计算产生的热量为1.42kJ,请写该反应的
热化学方程式: 。
(2)①已知:CH4(g)+H2O(g)===CO(g)+3H2(g) ΔH=+206.2 kJ·mol-1
CH4(g)+CO2(g)===2CO(g)+2H2(g) ΔH=+247.4 kJ·mol-1
则以甲烷为原料制取氢气是工业上常用的制氢方法。CH4(g)与H2O(g)反应生成CO2(g)和H2(g)的热化学方程式为: 。
②由气态基态原子形成1 mol化学键释放的最低能量叫键能。已知表中所列键能数据, 则
N2(g)+3H2(g)  2NH3(g) ΔH= kJ·mol-1。
2NH3(g) ΔH= kJ·mol-1。
| 化学键 | H—H | N—H | N≡N |
| 键能kJ·mol-1 | 436 | 391 | 945 |
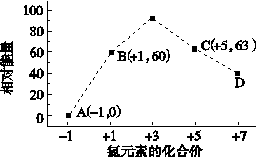
③一定条件下,在水溶液均为1 mol以下离子 Cl-、ClO-、ClO2-、ClO3-、ClO4-的能量(kJ)相对大小如下图所示,则3ClO-(aq)===ClO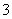 (aq)+2Cl-(aq)的ΔH= kJ·mol-1。
(aq)+2Cl-(aq)的ΔH= kJ·mol-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于胶体的叙述不正确的是
A. 布朗运动是胶体粒子特有的运动方式,可以据此把胶体和溶液、悬浊液区分开来。
B. 光线透过胶体时,胶体发生丁达尔现象。
C. 用渗析的方法净化胶体时,使用的半透膜只能让较小的分子.离子通过。
D. 胶体粒子具有较大的表面积,能吸附阳离子或阴离子,故在电场作用下会产生电泳现象。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述正确的是( )。
A. 氢氧化钠的摩尔质量是40g
B. 1mol NaOH的质量是40g/mol
C. 1g H2和1g N2所含分子数相等
D. 等质量的N2、CH4、CO、H2O中CH4所含分子数最多
查看答案和解析>>
科目:高中化学 来源: 题型:
相等物质的量的CO和CO2相比较,下列有关叙述中正确的是( )。
①它们所含的分子数目之比为1∶1; ②它们所含的O原子数目之比为1∶2; ③它们所含的原子总数目之比为2∶3; ④它们所含的C原子数目之比为1∶1;⑤它们所含的电子数目之比为7∶11
A.①②③④ B.②和③ C.④和⑤ D.①②③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
下列属于氧化还原反应的是( )
|
| A. | NaOH+HCl═NaCl+H2O | B. | Zn+2HCl═ZnCl2+H2↑ |
|
| C. | 2NaHCO3 | D. | CuO+2HCl═CuCl2+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
把河沙(主要成分是SiO2)跟镁粉按一定质量比(质量比大约为15∶24)混合均匀,装入试管中加热大约1 min后停止加热,发生剧烈反应,生成一种白色固体化合物和一种硅化物。待生成混合物冷却后放入盛有稀硫酸的烧杯中,立即产生气泡并伴有爆炸声,产生的气体是一种能在空气中自燃的气态氢化物。
(1)写出河沙与镁粉在加热条件下的化学方程式________________,该反应是________(填“放热”或“吸热”)反应。
(2)生成的混合物放入稀硫酸中,产生的气体是________(填化学式)。
(3)写出产生“爆炸声”的化学方程式:________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com