
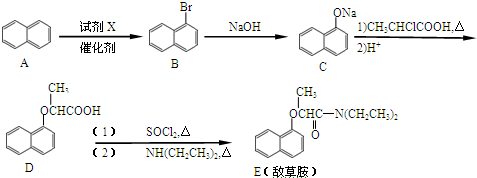
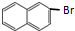
 .
.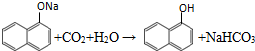 ;
;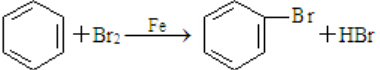 、C6H5Br+NaOH$→_{△}^{水}$C6H5OH+NaBr、C6H5ONa+CO2+H2O→C6H5OH+NaHCO3.
、C6H5Br+NaOH$→_{△}^{水}$C6H5OH+NaBr、C6H5ONa+CO2+H2O→C6H5OH+NaHCO3. 分析 (1)根据A的结构简式可知A的分子式;A生成B时,为取代反应,-Br可在与苯环的间位上;
(2)由苯的溴代反应分析;
(3)C中含酚钠结构,通入少量的二氧化碳反应生成苯酚结构与碳酸氢钠,W中含酚-OH,易被氧化,消耗氧气;
(4)由苯合成苯酚,可以用苯与溴 反应生成溴苯,溴苯在碱性条件下水解生成苯酚钠,再酸化可得苯酚.
解答 解:(1)根据A的结构简式可知A的分子式为C8H10,A生成B时,为取代反应,-Br可在与苯环的间位上,则副产物为 ,
,
故答案为:C8H10; ;
;
(2)由苯的溴代反应可知,试剂X应为液溴,故答案为:液溴;
(3)C中含酚钠结构,通入少量的二氧化碳反应生成苯酚结构与碳酸氢钠,该反应为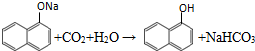 ,W为萘酚,含有酚羟基,易消耗氧气,具有抗氧化能力,
,W为萘酚,含有酚羟基,易消耗氧气,具有抗氧化能力,
故答案为: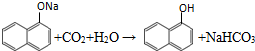 ;含有酚羟基,易消耗氧气,具有抗氧化能力;
;含有酚羟基,易消耗氧气,具有抗氧化能力;
(4)由苯合成苯酚,可以用苯与溴 反应生成溴苯,溴苯在碱性条件下水解生成苯酚钠,再酸化可得苯酚,反应的方程式为 、C6H5Br+NaOH$→_{△}^{水}$C6H5OH+NaBr、C6H5ONa+CO2+H2O→C6H5OH+NaHCO3,
、C6H5Br+NaOH$→_{△}^{水}$C6H5OH+NaBr、C6H5ONa+CO2+H2O→C6H5OH+NaHCO3,
故答案为: 、C6H5Br+NaOH$→_{△}^{水}$C6H5OH+NaBr、C6H5ONa+CO2+H2O→C6H5OH+NaHCO3.
、C6H5Br+NaOH$→_{△}^{水}$C6H5OH+NaBr、C6H5ONa+CO2+H2O→C6H5OH+NaHCO3.
点评 本题考查有机物的合成,为高频考点,把握合成流程中结构与官能团的变化、官能团与性质的关系为解答的关键,注意题中的流程,题目难度中等.


 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案科目:高中化学 来源: 题型:选择题
| A. | Fe3+、K+、SO42- | B. | Cu2+、SO42-、NO3- | C. | Na+、K+、Cl- | D. | MnO4-、K+、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2A溶液中一定有:c(OH-)=c(H+)+c(HA-) | |
| B. | Na2A溶液呈碱性,NaHA溶液可能酸性可能呈碱性 | |
| C. | Na2A溶液中一定有c(Na+)+c(H+)=c(OH-)+c(A2-)+c(HA-) | |
| D. | NaHA溶液一定有c(Na+)>c(HA)>c(OH-)>c(H2A)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素的单质氧化性:Z>Y>X | B. | 最高正化合价:Z>Y | ||
| C. | 原子半径:Z<Y<X | D. | 气态氢化物的稳定性:Z<Y<X |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | x+y<z | B. | 平衡向正反应方向移动 | ||
| C. | A的体积分数下降 | D. | B的浓度增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某研究性学习小组在研究二氧化硫漂白作用时,从“氯气的漂白作用实际上是氯气与水反应生成的次氯酸的漂白作用”得到启发.为了探究二氧化硫作用得到底是二氧化硫本身还是二氧化硫与水作用的产物,该小组设计了如下实验.请回答相关问题.
某研究性学习小组在研究二氧化硫漂白作用时,从“氯气的漂白作用实际上是氯气与水反应生成的次氯酸的漂白作用”得到启发.为了探究二氧化硫作用得到底是二氧化硫本身还是二氧化硫与水作用的产物,该小组设计了如下实验.请回答相关问题.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 取样,滴加AgNO3溶液,看是否有白色沉淀 | |
| B. | 取样,先加盐酸酸化,再加入AgNO3溶液,看是否有白色沉淀生成 | |
| C. | 取样,加少量AgNO3溶液,有白色沉淀,再加稀HCl,看白色沉淀是否消失 | |
| D. | 取样,加少量AgNO3溶液,有白色沉淀,再加稀HNO3,看白色沉淀是否消失 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2SO3溶液中:c(H+)+c(HSO3-)+2c(H2SO3)═c(OH-) | |
| B. | NH4HCO3溶于过量的NaOH溶液中:HCO3-+OH-═CO32-+H2O | |
| C. | 有些化学反应既属于复分解反应又属于氧化还原反应 | |
| D. | 常温下,将pH=3的HA和PH=11的BOH等体积混合后pH>7,可能生成了弱酸强碱盐 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com