
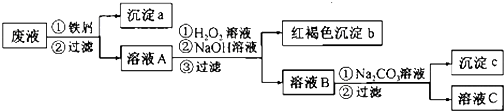
分析 酸性废液中含有Fe2+、Cu2+、Ba2+三种金属离子,加入铁屑,可置换出铜,沉淀a为Fe、Cu,溶液A含有Fe2+、Ba2+,然后在溶液A中加入过氧化氢、氢氧化钠生成的红褐色沉淀为Fe(OH)3↓,溶液B含有Na+、Ba2+,加入碳酸钠溶液,可生成沉淀c为BaCO3,溶液C含有的阳离子主要为Na+,以此解答该题.
解答 解:酸性废液中含有Fe2+、Cu2+、Ba2+三种金属离子,加入铁屑,可置换出铜,沉淀a为Fe、Cu,溶液A含有Fe2+、Ba2+,然后在溶液A中加入过氧化氢、氢氧化钠生成的红褐色沉淀为Fe(OH)3↓,溶液B含有Na+、Ba2+,加入碳酸钠溶液,可生成沉淀c为BaCO3,溶液C含有的阳离子主要为Na+,
(1)由以上分析可知沉淀a中含有的单质是Fe、Cu,故答案为:Fe、Cu;
(2)由分析可知沉淀c为BaCO3,故答案为:BaCO3;
(3)氧化时加入H2O2溶液与二价铁离子发生氧化还原反应,反应的离子方程式为2Fe2++2H++H2O2=2Fe3++2H2O,故答案为:2Fe2++2H++H2O2=2Fe3++2H2O.
点评 本题考查物质的分离提纯的综合应用,为高考常见题型,题目难度中等,注意掌握金属回收方法、常见的离子之间的反应,明确离子方程式的书写方法,试题培养了学生的分析、理解能力及灵活应用所学知识的能力.


科目:高中化学 来源: 题型:解答题
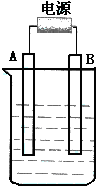 如图用石墨作电极的电解池中,放入500mL含一种溶质的某蓝色溶液进行电解,观察到A电极表面有红色的固态物质生成,B电极有无色气体生成;当溶液中的原有溶质完全电解后,停止电解,取出A电极,洗涤、干燥、称量、电极增重1.6g,请回答下列问题:
如图用石墨作电极的电解池中,放入500mL含一种溶质的某蓝色溶液进行电解,观察到A电极表面有红色的固态物质生成,B电极有无色气体生成;当溶液中的原有溶质完全电解后,停止电解,取出A电极,洗涤、干燥、称量、电极增重1.6g,请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
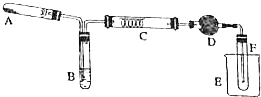 某化学兴趣小组对实验室乙醇催化氧化实验装置进行了改进,如图:试管A内为高锰酸钾固体,试管B内为无水乙醇,硬质试管C内为绕成螺旋状的细钢丝,干燥管D内为无水硫酸铜粉末.(图中加热仪器、夹持装置等都已略去)
某化学兴趣小组对实验室乙醇催化氧化实验装置进行了改进,如图:试管A内为高锰酸钾固体,试管B内为无水乙醇,硬质试管C内为绕成螺旋状的细钢丝,干燥管D内为无水硫酸铜粉末.(图中加热仪器、夹持装置等都已略去)查看答案和解析>>
科目:高中化学 来源: 题型:解答题
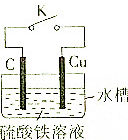 某同学为了探究原电池原理,设计如图所示装置:
某同学为了探究原电池原理,设计如图所示装置:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:
某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:| 滴定次数 | 待测液体积(mL) | 标准盐酸体积(mL) | |
| 滴定前读数(mL) | 滴定后读数(mL) | ||
| 第一次 | 25.00 | 0.50 | 20.40 |
| 第二次 | 25.00 | 4.00 | 24.10 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
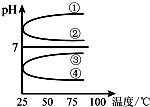 A、B、C、D、E五种溶液分别是NaOH、NH3•H2O、CH3COOH、HCl、NH4HSO4中的一种.常温下进行下列实验:
A、B、C、D、E五种溶液分别是NaOH、NH3•H2O、CH3COOH、HCl、NH4HSO4中的一种.常温下进行下列实验:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com