
离子方程式H++OH﹣=H2O可表示的化学反应是( )
|
| A. | 盐酸和氢氧化钡的反应 | B. | 硝酸和氢氧化镁的反应 |
|
| C. | 硫酸和氢氧化钡的反应 | D. | 盐酸和氢氧化铜反应 |
考点:
离子方程式的书写.
专题:
离子反应专题.
分析:
稀的强酸与稀的强碱生成可溶于盐和水的反应,可以用离子方程式H++OH﹣=H2O表示,以此来解答.
解答:
解:离子方程式H++OH﹣=H2O表示稀的强酸与稀的强碱生成可溶于盐和水的反应.
A、盐酸是强酸,氢氧化钡是强碱,生成的氯化钡是易溶于水的盐,可以用离子方程式H++OH﹣=H2O表示,故A正确;
B、硝酸是强酸,氢氧化镁是弱碱,不可以用离子方程式H++OH﹣=H2O表示,故B错误;
C、硫酸和氢氧化钡的反应的离子反应为2H++SO42﹣+Ba2++2OH﹣=BaSO4↓+2H2O,硫酸钡是难溶于水的盐,故C错误;
D、盐酸是强酸,氢氧化铜是弱碱,不可以用离子方程式H++OH﹣=H2O表示,故D错误.
故选A.
点评:
本题考查离子反应方程式的书写,明确物质的溶解性、常见的弱电解质在离子反应中应保留化学式是解答本题的关键,难度不大.


科目:高中化学 来源: 题型:
强酸和强碱在稀溶液里反应的热化学方程式可表示为:H+(aq)+OH﹣(aq)═H2O(l)△H=﹣57.3kJ•mol﹣1已知:CH3COOH(aq)+NaOH(aq)═CH3COONa(aq)+H2O(l)△H=﹣Q1 kJ•mol﹣1 HNO3(aq)+NaOH(aq)═NaNO3(aq)+H2O(l)△H=﹣Q2 kJ•mol﹣1上述均是在溶液中进行的反应,Q1、Q2的关系正确的是()
A. Q1=Q2=57.3 B. Q1>Q2>57.3 C. Q1<Q2=57.3 D. 无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
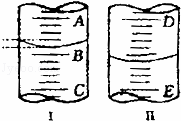
(如图)(1)图Ⅰ表示10mL量筒中液面的位置,A与B、B与C刻度相差1mL,如果刻度A为5,量筒中液体体积是 mL.
(2)图Ⅱ表示25mL滴定管中液面的位置,如果液面处的读数是a,则滴定管中液体的体积(填代号) .
A.是a mL B.是(25﹣a)mLC.一定大于a mL D.一定大于(25﹣a)mL
(3)已知N2(g)+2O2(g)═2NO2(g);△H=+67.7KJ/mol,
N2H4(g)+O2(g)═N2(g)+2H2O(g);△H=﹣534KJ/mol,
则肼与NO2完全反应的热化学方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组中的离子,能在溶液中大量共存的是( )
|
| A. | K+、Mg2+、NO3﹣、Cl﹣ | B. | Ba2+、Na+、CO32﹣、OH﹣ |
|
| C. | Mg2+、Ba2+、OH﹣、NO3﹣ | D. | H+、K+、CO32﹣、SO42﹣ |
查看答案和解析>>
科目:高中化学 来源: 题型:
用0.1mol/L的Na2SO3溶液30mL,恰好将2×10﹣3 mol XO4﹣还原,则元素X在还原产物中的化合价是( )
|
| A. | +4 | B. | +3 | C. | +2 | D. | +1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
欲配制100mL 1.0mol•L﹣1Na2SO4溶液,正确的方法是()
①将14.2g Na2SO4溶于100mL水中
②将32.2gNa2SO4•10H2O溶于少量水 中,再用水稀释至100mL
③将20mL 5.0mol•L﹣1Na2SO4溶液用水稀释至100mL.
A. ①② B. ②③ C. ①③ D. ①②③
查看答案和解析>>
科目:高中化学 来源: 题型:
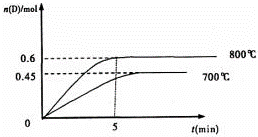
在容积为1L的密闭容器中,进行如下反应:A(g)+2B(g)⇌C(g)+D(g),在不同温度下,D的物质的量n(D)和时间t的关系如图.试回答下列问题:
(1)800℃时.0﹣5min内,以B表示的平均反应速率为 .
(2)能判断该反应达到化学平衡状态的依据是
A.容器中压强不变 B.混合气体中c(A)不变
C.2v正(B)=v逆(D) D.c(A)=c(C)
(3 )若最初加入1.0molA和2.2molB,利用图中数据计算800℃时的平衡常数K= 反应为 填吸热或放热)
)若最初加入1.0molA和2.2molB,利用图中数据计算800℃时的平衡常数K= 反应为 填吸热或放热)
(4)700℃时,某时刻测得体系中各物质的量如下:n(A)=1.1mol,n(B)=2.6mol,n(C)=0.9mol,
n(D)=0.9mol,则此时该反应向 填“向正反应方向”“向逆反应方向”或“处于平衡状态”).
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com