
分析 (1)根据配制步骤是计算、称量、溶解、冷却、移液、洗涤、定容、摇匀、装瓶来分析需要的仪器;
(2)用于盛装液体的带塞子的容器使用前均必须查漏;
(3)根据c=$\frac{n}{V}$并结合溶质的物质的量n和溶液的体积V的变化来进行误差分析;
(4)配制过程中的操作失误,能补救就补救,不能补救就需重新配制.
解答 解:(1)根据配制步骤是计算、称量、溶解、冷却、移液、洗涤、定容、摇匀、装瓶可知所需的玻璃仪器有:烧杯、玻璃棒、量筒、500mL容量瓶和胶头滴管,故答案为:500mL容量瓶和胶头滴管;
(2)用于盛装液体的带塞子的容器使用前均必须查漏,如容量瓶、分液漏斗和滴定管,即容量瓶使用前必须查漏,故答案为:查漏;
(3)A.未洗涤溶解NaCl的烧杯,会导致溶质的损失,则所配溶液的浓度偏小;
B.往容量瓶中移液时,有少量液体溅出,会导致溶质的损失,则所配溶液的浓度偏小;
C.定容时俯视刻度线,则导致溶液体积偏小,则浓度偏大;
D.若容量瓶未干燥即用来配制溶液,对溶液浓度无影响,因为只要定容时正确,至于水是原来就有的还是后来加入的,对浓度无影响;
E.定容后盖上瓶塞反复摇匀,静置后,由于瓶塞处有溶液残留,故发现液面不到刻度线是正常的,再加水至刻度线会导致溶液浓度偏小.
故浓度偏大的有:C;浓度偏小的有:ABE;无影响的有:D.
故答案为:C;ABE;D.
(4)若配制时,因加水不慎略超过了容量瓶刻度线,无法补救,故只能重新配制,故答案为:重新配制.
点评 本题考查了一定物质的量浓度溶液的配制过程中的计算和误差分析,属于基础型题目,难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | NH3•H2O?NH4++OH- | B. | H2SO3?2H++SO32- | ||
| C. | Fe(OH)3?Fe3++3OH- | D. | H2SO4→2H++SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
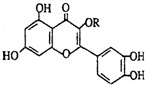 )存在于槐树花蕾中,它是一种营养增补剂.关于维生素P的叙述错误的是( )
)存在于槐树花蕾中,它是一种营养增补剂.关于维生素P的叙述错误的是( )| A. | 1mol维生素P最多可以和5mol溴水发生加成反应 | |
| B. | 可溶于有机溶剂 | |
| C. | 分子中有三个苯环 | |
| D. | 1mol维生素P最多可以和4molNaOH反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 第IA族的所有元素都是金属元素 | |
| B. | 同周期主族元素中,第ⅦA族元素原子半径最小 | |
| C. | 稀有气体元素原子的最外层电子数均为8 | |
| D. | 一般在元素周期表的金属与非金属分界线附近寻找一些化学反应新型催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
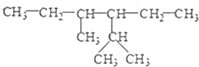 的系统命名为:2,4-二甲基-3-乙基乙烷
的系统命名为:2,4-二甲基-3-乙基乙烷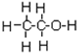 ,乙烯的电子式为
,乙烯的电子式为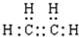
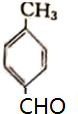 <
<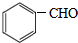
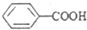 >CH3COOH(提示:类比酚与醇的酸性)
>CH3COOH(提示:类比酚与醇的酸性)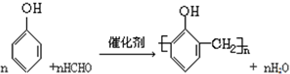
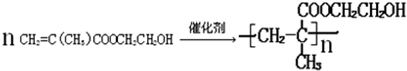 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江西省高二上10月月考化学试卷(解析版) 题型:选择题
用0.1000mol•L﹣1NaOH溶液滴定未知浓度的HCl溶液,下列叙述正确的是( )
A.酸式滴定管在装酸液前未用待装液润洗2~3次,使测定结果偏大
B.滴定终点时,俯视读数,使测定结果偏小
C.只能选用酚酞作指示剂
D.滴入最后一滴NaOH溶液,溶液突然变色,即为滴定终点
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
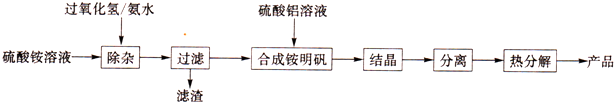
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com