
氧化还原反应实际上包含氧化和还原两个过程。
(1)向氯酸钠的酸性水溶液中通入二氧化硫,该反应中氧化过程的反应式为:
SO2+2H2O – 2e– → SO42– + 4H+;
(2)向亚氯酸钠(NaClO2)固体中通入用空气稀释的氯气,该反应中还原过程的反应式为:Cl2 + 2e– → 2Cl–。 在(1)和(2)反应中均会生成产物X,则X的化学式为( )
A.NaClO B.NaClO4 C.HClO D.ClO2
科目:高中化学 来源: 题型:
已知C(石墨,s)===C(金刚石,s)(吸热反应),P4(白磷,s)===4P(红磷,s)(放热反应),下列判断正确的是( )
A.说明金刚石的内能比石墨低
B.说明红磷比白磷稳定
C.说明红磷比金刚石稳定
D.此种变化为物理变化
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A.使紫色石蕊试剂显红色的溶液:NH4+、K+、[Al(OH)4]-、NO3-
B.稀HNO3溶液: Na+、Mg2+、SO42-、Cl-
C.FeCl3溶液:K+、Na+、I-、SO42-
D.由水电离产生的c(H+)=10-13 mol·L-1的溶液:K+、Na+、Cl-、HCO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
用海带灰制备单质碘的实验中,涉及的操作正确且能达到实验目的的是( )
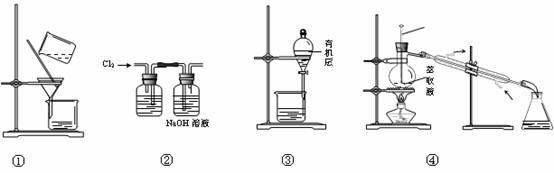
A.用图①所示装置,过滤海带灰浸取液
B.用图②所示装置,在滤液中通入Cl2
C.用图③所示装置,先放出下层液体,再放出有机层
D.用图④所示装置,回收萃取剂苯并获得单质碘
查看答案和解析>>
科目:高中化学 来源: 题型:
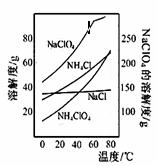
高氯酸铵可用于火箭推进剂,实验室可由NaClO3等原料制取(部分物质溶解度如下图),其实验流程如下:
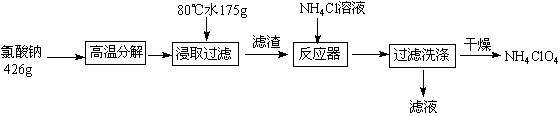
(1)氯酸钠受热分解生成高氯酸钠和氯化钠的化学方程式为 。
(2)80℃时浸取液冷却至0℃过滤,滤渣的主要成分为 (写化学式)。
(3)反应器中加入氯化铵饱和溶液发生反应的离子方程式为 。
(4)已知:2NH4ClO4  N2↑+ 2O2↑ + Cl2↑ +4H2O,现可提供下列试剂:
N2↑+ 2O2↑ + Cl2↑ +4H2O,现可提供下列试剂:
a.饱和食盐水 b.浓H2SO4 c.NaOH溶液 d.Mg e.Cu f.Fe
利用下图装置对高氯酸铵热分解产生的三种气体进行分步吸收或收集。
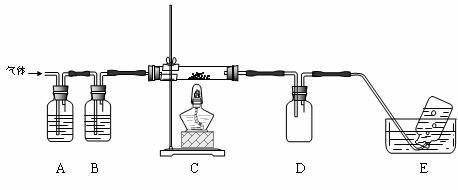
① E中收集到的气体可能是 (填化学式) 。
②装置D的作用可能是 。
③ A、B、C中盛放的药品依次可以是 (选填:Ⅰ、Ⅱ、Ⅲ)。
Ⅰ.a b d Ⅱ.c b e Ⅲ.b c f
查看答案和解析>>
科目:高中化学 来源: 题型:
某Na2CO3、NaAlO2的混合溶液中逐滴
加入1mol·L-1的盐酸,测得溶液中的CO32-、HCO3-、AlO2-、Al3+的物质的量与加入盐酸溶液的体积变化关系如图所示。请根据图像推断,下列说法中不正确的是(已知HCO3-与AlO2-在溶液中不能共存)
A.M点时生成的CO2为0 mol
B.原混合溶液中的CO32-与AlO2-的物质的量之比为1:2
C.V1:V2=1:4
D.a段表示的离子方程式为:AlO2- +H+ + H2O=Al(OH)3↓

查看答案和解析>>
科目:高中化学 来源: 题型:
二氧化氯(ClO2)是目前国际上公认的第四代高效、
无毒的消毒剂,是一种黄绿色的气体,易溶于水。
Ⅰ.(1) ClO2可由KClO3在H2SO4存在的条件下与Na2SO3反应制得。则该反应的氧化产物与
还原产物的物质的量之比是________。
Ⅱ.实验室也可用NH4Cl、盐酸、NaClO2(亚氯酸钠)为原料制备ClO2,其流程如下:
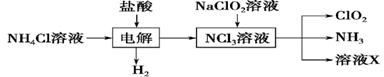
(2) 写出电解时发生反应的化学方程式:____________。
(3) 除去ClO2中的NH3可选用的试剂是________。(填序号)
A.饱和食盐水 B.碱石灰
C.浓硫酸 D.水
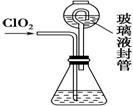
(4) 测定ClO2(如右图)的过程如下:在锥形瓶中加入足量的碘化钾,用100 mL水溶解后,
再加3 mL硫酸溶液;在玻璃液封管中加入水;将生成的ClO2气体通过导管在锥形瓶中被吸收;将玻璃封管中的水封液倒入锥形瓶中,加入几滴淀粉溶液,用c mol·L-1硫代硫酸钠标准溶液滴定(I2+2S2O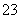 = 2I-+S4O
= 2I-+S4O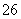 ),共用去V mL硫代硫酸钠溶液。
),共用去V mL硫代硫酸钠溶液。
①装置中玻璃液封管的作用是_______________________________________。
②请写出上述二氧化氯气体与碘化钾溶液反应的离子方程式__________________。
③滴定终点的现象是________________________________________________。
④测得通入ClO2的质量m(ClO2)=________。(用含c、V的代数式表示)
(5) 用ClO2处理过的饮用水(pH为5.5~6.5)常含有一定量对人体不利的亚氯酸根离子ClO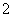 。
。
2001年我国卫生部规定,饮用水的ClO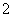 含量应不超过0.2 mg·L-1。若饮用水中ClO
含量应不超过0.2 mg·L-1。若饮用水中ClO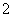 的含量超标,可向其中加入适量的Fe2+,该反应的氧化产物是____________ (填化学式),其发生反应的离子方程式为_________________ __________。
的含量超标,可向其中加入适量的Fe2+,该反应的氧化产物是____________ (填化学式),其发生反应的离子方程式为_________________ __________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组离子在溶液中既可以大量共存,且加入氢氧化钠溶液后也不产生沉淀的是( )
A.Na+、Ba2+、Cl-、SO B.K+、Na+、NO
B.K+、Na+、NO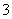 、OH-
、OH-
C.H+、NH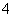 、Fe3+、SO
、Fe3+、SO D.H+、Cl-、CH3COO-、NO
D.H+、Cl-、CH3COO-、NO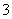
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com