
����Ŀ����ʹ������к͵ζ����ⶨ���۰״�Ũ��
��.ʵ�鲽��
(1)���ƴ���״���Һ����________(����������)��ȡ1.00mLʳ�ð״ף���______(����������)����ˮϡ�ͺ�ת�Ƶ�100mL________(����������)�ж��ݣ�ҡ�ȼ��ô���״���Һ
(2)��ȡ����״���Һ20.00mL����ƿ�У������еμ�2�η�̪��ָʾ��
(3)��ȡʢװ0.1000mol��L-1NaOH��Һ�ļ�ʽ�ζ��ܵij�ʼ����
(4)�ζ����жϵζ��յ��������__________�ﵽ�ζ��յ㣬ֹͣ�ζ�������¼NaOH��Һ�����ն������ظ��ζ�3�Ρ�
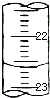
(5)��ͼ��ij�εζ�ʱ�ĵζ����е�Һ�棬�����Ϊ______ mL.
��.ʵ���¼
ʵ������(mL)/�ζ����� | 1 | 2 | 3 | 4 |
V(��Ʒ) | 20.00 | 20.00 | 20.00 | 20.00 |
V(NaOH)(����) | 15.95 | 15.00 | 15.05 | 14.95 |
��.���ݴ���������
(6)��ͬѧ�ڴ�������ʱ�����:c(���۰״�)��______mol��L-1
(7)��ʽ�ζ���������ˮ��ϴ��δ�ñ�Һ��ϴ���µζ����_____(�ƫС����ƫ����Ӱ�족):�۲��ʽ�ζ��ܶ���ʱ�����ζ�ǰ���ӣ��ζ����ӣ������ᵼ�²�õİ״�Ũ�ȵIJⶨֵ______(�ƫС����ƫ����Ӱ�족)��
���𰸡���ʽ�ζ��� �ձ� ����ƿ ��Һ����ɫ���dz��ɫ���Ұ�����ڲ���ɫ 22.60 0.75 ƫ�� ƫС
��������
��1���״�Ϊ���ԣ���ȡ10.00mL�״�Ӧѡ�����Եζ�����ȡ�����ձ���ϡ�ͣ����������ƿ�����ƣ�
��4������Ϊ���ԣ������̪Ϊ��ɫ���ζ��յ�ʱ��Һ����ɫǡ�ñ�Ϊdz��ɫ�����ڰ�����ڲ���ɫ��
��5�����ݵζ��ܵĽṹ�뾫ȷ����������
��6���������ݵĺ����������������ƽ�����ĵ�NaOH��Һ�������Ȼ����ݰ״���NaOH ��Һ��Ӧ�Ĺ�ϵʽ�����
��7���������������ı�Һ�����Ӱ�죬����c�����⣩= ![]() ������
������
I����1��������Һ������ʽ�ζ�����ȡ����ȡ���Һ�����ձ����ܽ�ϡ�ͣ���Һ�Ķ����ڶ�Ӧ���������ƿ�н��У�
��4��NaOH�ζ�ʳ���յ�ʱ����Һ������Ϊ�����ƣ������һ������������Һ�������Һ������ǿ����˵ζ��յ�����Ϊ����Һ����ɫǡ�ñ�Ϊ��ɫ�����ڰ�����ڲ���ɫ��
��5���ζ��ܴ������¶���Խ��Խ����ʱ������λС���������Ϊ��22.60��
II����6����1�εζ�������Դ����쳣ֵ��Ӧ��ȥ��3������NaOH��Һ�����Ϊ��15.00mL��15.05mL��14.95mL����NaOH��Һ��ƽ�����Ϊ15.00mL��
��20mL����״��к��� CH3COOH ���ʵ���n����n=n(NaOH)=0.1mol/L��0.015L=0.0015mol����100mL��Ʒ�к��д������ʵ���Ϊ��0.0015mol��![]() =0.0075mol�����ʵ���Ũ��Ϊ��
=0.0075mol�����ʵ���Ũ��Ϊ��![]() =0.750mol/L��
=0.750mol/L��
��7����ʽ�ζ���������ˮ��ϴ��δ�ñ�Һ��ϴ���������ĵ�����������Һ���ƫ�����յ��µζ����ƫ�ζ�ǰ���ӣ��ζ����ӣ����¶���ƫС���ᵼ�²�õİ״�Ũ�ȵIJⶨֵƫС��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ�������£����ܱ������У��ܱ�ʾ��ӦX(g)��2Y(g)![]() 2Z(g)һ���ﵽ��ѧƽ��״̬����(����)
2Z(g)һ���ﵽ��ѧƽ��״̬����(����)
��X��Y��Z�����ʵ���֮��Ϊ1��2��2
��X��Y��Z��Ũ�Ȳ��ٷ����仯
�������е�ѹǿ���ٷ����仯
�ܵ�λʱ��������n mol Z��ͬʱ����2n mol Y
A.�٢�B.�٢�C.�ڢ�D.�ۢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ָ����Ӧ�����ӷ���ʽ��ȷ����
A.��ʯī�缫���MgCl2��Һ:Mg2+��2Cl-��2H2O![]() Mg(OH)2����Cl2����H2��
Mg(OH)2����Cl2����H2��
B.��ĭ���������ʱ��ѧ��Ӧ:2Al3+��3CO32-��6H2O��Al(OH)3����3CO2��
C.��Ca(HCO3)2��Һ�еμ�����NaOH��Һ:Ca2+��2HCO3-��2OH-��CaCO3����CO32-��2H2O
D.���Ƶ�ˮ�ⷴӦ��S2-��H3O+��HS-��H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
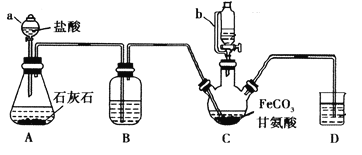
����Ŀ���ʰ�������[(NH2CH2COO)2Fe]��һ�ֲ���ǿ������ijѧϰС������FeCO3��ʰ���(NH2CH2COOH)�Ʊ��ʰ���������ʵ��װ������ͼ��ʾ(�гֺͼ���������ʡ��)��
�й������������±���
�ʰ��� | ������ | �ʰ������� |
������ˮ�������Ҵ� | ������ˮ���Ҵ� | ������ˮ���������Ҵ� |
���Ի����� | ǿ���ԡ�ǿ��ԭ�� |
ʵ����̣�
I���ϳɣ�װ��C��ʢ��0.1mol FeCO3��200mL1.0mol��L-1�ʰ�����Һ�����������ᡣʵ��ʱ���ȴ�����a�Ļ�������װ��c�п����ž����Ȳ����Ͻ��裬��ͨ������b��C�м�����������������Һ����p�ȵ�6���ң�ʹ��Ӧ���ַ�Ӧ��
�������룺��Ӧ�������ˣ�����Һ��������Ũ����������ˮ�Ҵ������ˡ�ϴ�Ӳ����
�ش��������⣺
��1������a��������________����a��ȣ�����b���ŵ���_____________________________��
��2��װ��B��ʢ�е��Լ���____________��ʵ�������װ��D�ĵ���һֱû��Һ���µı�Ҫ����___________________________________________��
��3���ϳɹ��̼���������������Ǵٽ�FeCO3�ܽ��________________________ ��
��4����������������Һ����pH������6���ʰ������������½���ԭ��������ӷ���ʽ��ʾΪ________��
��5������II�м�����ˮ�Ҵ���Ŀ����_______________________��
��6�������Ʒ���Ƿ���Fe3+���Լ�������_________ ��
��7����ʵ���Ƶ�15.3g�ʰ���������M=204g/mol�������������_____����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Y��ҽҩ�Ͼ��й㷺��;������X�Ƶá������йػ�����X��Y��˵����ȷ���ǣ� ��

A.X����������ԭ�ӿ�����ͬһƽ����
B.1molY�������1molNaOH��Ӧ
C.X��Y����������KMnO4��Һ��Ӧ
D.X��Y�ֱ�������H2�ӳɵIJ������������̼ԭ����Ŀ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵������ȷ���ǣ� ��
A.��ϩ�����е� ��������������Ϊ 5��1
B.ijԪ����̬��̬ԭ�ӵ������ܣ�kJmol��1���ֱ�Ϊ 738��1451��7733��10540��13630��17995��21703�� ������������Ӧʱ�������ɵ��������� X2+
C.Na��P��Cl �ĵ縺����������
D.�������[TiCl��H2O��5]Cl2H2O ��Һ�м��������� AgNO3 ��Һ������ Cl-������ȫ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������̼�����һ�ֹ㷺Ӧ�õĹ�ҵ���ϣ���Ҫ�������ϡ���ֽ����Ϳ�ϵȡ���ҵ������ʯ�ࣨ��Ҫ�ɷ�ΪCaSO4��������Ҫ��SiO2��FeO��Fe2O3��Al2O3�ȣ�Ϊԭ���Ʊ�����̼��ơ���֪̼��Ƶ��ܽ�ȱ�����Ƶ��ܽ��С����һ���¶��£������ӿ�ʼ������pHֵΪ12.3������������ʼ�ܽ��pHֵΪ12.0���������������γ�����������������pH�ķ�Χ���£�
�������� | ��ʼ������pH | ������ȫ��pH |
Fe3+ | 1.5 | 2.8 |
Fe2+ | 5.5 | 8.3 |
Al3+ | 3.0 | 4.7 |
�Ʊ�������ͼ��

���ʴ�
��1������˵����ȷ����__��
A.�ܽ�Ĺ����У������������������
B.����1����Ҫ�ɷ���SiO2������2����Ҫ�ɷ���Fe(OH)3��Al(OH)3
C.ת��ʱ��������ͨ���������ͺ���ͨ����������̼������߸����ӵ�ת����
D.ת��ʱ�����ʵ����ȣ��Լӿ췴Ӧ����
E.ϴ��ʱ���Բ�����Һ3
��2��������ҺpH��Χʱ����ѵ�pH��Χ��__��������__��
��3��̼��Ʋ�Ʒ�иƺ����IJⶨ��
�õ�����ƽȷ������Ʒ2.000g�ڸɾ����ձ��У��μ�2mol/L������ǡ����ȫ�ܽ⣬������ˮ����������ȥ����������pH=6��7��ת����250mL������ƿ�У�����ҡ�ȡ�����Һ��ȷ��ȡ25.00mL��Һ����ƿ�У�����NaOH��Һ10mL��ҡ�ȣ������ָʾ��30mg�����ѱ궨��EDTA���Ҷ��������ᣬ���Ա�ʾΪH4Y������Һ���еζ���
��֪��Ca2++Y4-=[CaY]2-���ⶨ�������£�
�����Ʒ��Һ�����mL�� | ����EDTA����Һ�����mL�� | EDTA����Һ��Ũ�ȣ�mol�� | |
1 | 25.00 | 14.90 | 0.1121 |
2 | 25.00 | 16.72 | 0.1121 |
3 | 25.00 | 15.00 | 0.1121 |
4 | 25.00 | 15.10 | 0.1121 |
�ٽ��������ζ�����ʵ��Ĺ����У����в���������ȷ����__��
A.ʹ����Һ����ȡ��Һ��ʱ����Һ�ܼ��첻�ܽӴ�������
B.�ζ���ˮϴ����Ҫ�ñ���Һ��ϴ3�Σ����ų����ݣ�ʹҺ��λ����0���̶Ȼ���0���̶�����
C.�ζ��ܵ�Һ����農��1��2min���ٽ��ж�ȡ�̶����ݽ��м�¼
D.������ƽ����ʱ�����߲���Ӧͬʱ���ڴ�״̬��ʹ����������ͨ
�ڸò�Ʒ�и�Ԫ�ص���������Ϊ__��������λ��Ч���֣������ζ�����ʱ���Ӷ�������ⶨ�Ľ��__������ƫ��������ƫС��������Ӱ��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ���¶��£��ں����ܱ������н��п��淴Ӧ2NO2(g)![]() 2NO(g)+O2(g)�����п�����Ϊ��Ӧ�ﵽ��ѧƽ��״̬��־���У� ��
2NO(g)+O2(g)�����п�����Ϊ��Ӧ�ﵽ��ѧƽ��״̬��־���У� ��
A.��λʱ��������nmolO2��ͬʱ����2nmolNO
B.NO2��NO��O2�����ʵ���֮��Ϊ2��2��1��״̬
C.�ܱ�������ѹǿ���ٸı��״̬
D.�ܱ�������������ܶȲ��ٸı��״̬
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������е� 4����ԭ�Ӷ�������ȡ�����ɵõ����ӽṹΪ���� ����Ը��л����������������ȷ���ǣ�����
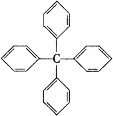
A.����ʽΪ C25H24
B.���ڱ���ͬϵ��
C.����̼ԭ���п��ܴ���ͬһƽ����
D.��һ�������£��ܷ���ȡ�����ӳɷ�Ӧ
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com