
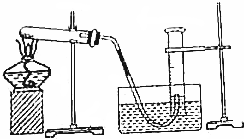
分析 (1)通过气体发生器与液体构成封闭体系,依据改变体系内压强时产生的现象(如气泡的生成、水柱的形成、液面的升降等)来判断装置气密性的好坏;一般用到的方法有:空气热胀冷缩法、注水法等;据此解答;
(2)从气体的热胀冷缩和读量筒中气体体积的方法两方面进行分析;
(3)观察装置图可知,量筒内液面高于水槽液面,只要将量筒慢慢下移即可,从气体的热胀冷缩和读量筒中气体体积的方法两方面进行分析;
(4)依据标况下的氧气体积是cL,计算氧气的质量和物质的量,依据M=$\frac{m}{n}$计算.
解答 解:(1)装置气密性检查方法:将导管的出口浸入水槽的水中,手握住试管,有气泡从导管口逸出,放开手后有少量水进入导管,表明不漏气;
故答案为:将导管的出口浸入水槽的水中,手握住试管,有气泡从导管口逸出,放开手后有少量水进入导管,表明不漏气;
(2)要准确测量气体体积必须保持量筒内外气体的温度和压强相等,因此在读取量筒内气体的体积之前,应使试管和量筒内的气体都冷却至室温;再调节量筒内外液面高度使之相同,所以正确的顺序为:②①③;
故答案为:②①③;
(3)试管和量筒内的气体都冷却后,量筒内的液面一定高于量筒外的液面,慢慢将量筒下移,量筒上方气体体积减小,压强增大,当量筒内气体压强等于外界大气压时,量筒内液面和水槽内液面相平;
故答案为:慢慢将量筒下移;
(4)标况下,Vm=22.4L/mol,则氧气的物质的量n=$\frac{cL}{22.4L/mol}$,氧气的质量=(a-b)g;
依据M(O2)=$\frac{m}{n}$=$\frac{(a-b)g;}{\frac{cL}{22.4L/mol}}$=$\frac{22.4(a-b)}{c}$(g/mol);
故答案为:$\frac{22.4(a-b)}{c}$.
点评 本题为实验题,侧重考出制取气体装置气密性检验、气体体积测量方法,熟悉基本实验操作是解题关键,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4L氢气和氧气的混合气体,所含分子数为NA | |
| B. | 常温常压下,1mol氦气含有的原子数为2NA | |
| C. | 1molAl3+含有核外电子数为10NA | |
| D. | 17gNH3含有的电子数为10NA |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
| IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 | |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 4 | ⑨ | ⑩ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | Fe2++Cl2→Fe3++2Cl- | |
| B. | 2Fe2++2Br-+2I-+3Cl2=2Fe3++I2+Br2+6Cl- | |
| C. | 2Fe2++4Br-+2I-+4Cl2→2Fe3++I2+2Br2+8Cl- | |
| D. | 4Fe2++2Br-+2I-+4Cl2=4Fe3++I2+Br2+8Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com