
【题目】将 4 molA气体和3molB气体在2L的容器中混合并在一定条件下发生如下反应:2A(g)+B(g)![]() 2C(g), 若经 2 s后测得 C的浓度为 0.6 molL-1,现有下列几种说法:
2C(g), 若经 2 s后测得 C的浓度为 0.6 molL-1,现有下列几种说法:
①用物质A 表示反应的平均速率为 0.3 molL-1s-1
②物质 B的体积分数是40%
③2 s 时物质 A 的转化率为30%
④2 s 时物质 B 的浓度为 1.0 molL-1
其中正确的是
A.①④B.②③C.①③D.③④
 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案科目:高中化学 来源: 题型:
【题目】已知某“84消毒液”瓶体部分标签如图所示,该“84消毒液”通常稀释到100倍(体积之比)后使用。请回答下列问题:
(1)该“84消毒液”的物质的量浓度约为______mol·L-1。
84消毒液
有效成分:NaClO
规格:1000 mL
质量分数:25%
密度:1.19 g·cm-3
(2)该同学参阅该“84消毒液”的配方,欲用NaClO固体配制480 mL该物质的量浓度的消毒液。下列说法正确的是_____(填字母)。

A.如图所示的仪器中,有三种是不需要的,还需要一种玻璃仪器
B.容量瓶用蒸馏水洗净后,应烘干后才能用于配制溶液
C.配制过程中,未用蒸馏水洗涤烧杯和玻璃棒可能导致结果偏低
D.需要称量NaClO固体的质量为143.0g
(3)“84消毒液”与稀盐酸混合会产生一种黄绿色的气体,写出反应的离子方程式:_____
(4)钛铁矿(主要成分为FeTiO3,Ti为+4价)加盐酸“酸浸”后,钛主要以TiOCl42-形式存在,写出反应的离子方程式:_______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氯乙醛(CCl3CHO)是生产农药、医药的重要中间体,实验室制备三氯乙醛的反应装置示意图(加热装置未画出)和有关数据如下:
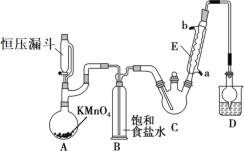
①制备反应原理:C2H5OH+4Cl2→CCl3CHO+5HCl
②相关物质的相对分子质量及部分物理性质:
相对分子质量 | 熔点/℃ | 沸点/℃ | 溶解性 | |
C2H5OH | 46 | -114.1 | 78.3 | 与水互溶 |
CCl3CHO | 147.5 | -57.5 | 97.8 | 可溶于水、乙醇 |
CCl3COOH | 163.5 | 58 | 198 | 可溶于水、乙醇、三氯乙醛 |
C2H5Cl | 64.5 | -138.7 | 12.3 | 微溶于水,可溶于乙醇 |
(1)恒压漏斗中盛放的试剂的名称是_____,盛放KMnO4仪器的名称是_____。
(2)反应过程中C2H5OH和HCl可能会生成副产物C2H5Cl,同时CCl3CHO(三氯乙醛)也能被次氯酸继续氧化生成CCl3COOH(三氯乙酸),写出三氯乙醛被次氯酸氧化生成三氯乙酸的化学方程式:_____。
(3)该设计流程中存在一处缺陷是_____,导致引起的后果是_____,装置B的作用是______。
(4)反应结束后,有人提出先将C中的混合物冷却到室温,再用分液的方法分离出三氯乙酸。你认为此方案是否可行_____(填是或否),原因是_____。
(5)测定产品纯度:称取产品0.36g配成待测溶液,加入0.1000molL1碘标准溶液20.00mL,再加入适量Na2CO3溶液,反应完全后,加盐酸调节溶液的pH,立即用0.02000molL1Na2S2O3溶液滴定至终点。进行三次平行实验,测得平均消耗Na2S2O3溶液20.00mL。则产品的纯度为_____(计算结果保留四位有效数字)。滴定原理:CCl3CHO+OH-=CHCl3+HCOO-、HCOO-+I2=H++2I-+CO2、I2+2S2O32-=2I-+S4O62-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答下列各题:
(1)![]() 中非含氧官能团的名称是_______;含氧官能团的电子式为_______。
中非含氧官能团的名称是_______;含氧官能团的电子式为_______。
(2)![]() 的系统命名为_______。
的系统命名为_______。
(3)写出CH3CH2CHO的银镜反应方程式:_______。
(4)2,6-二甲基-4-乙基辛烷的结构简式为_______,1 mol该烃完全燃烧需消耗氧气_______mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硝酸钙晶体[Ca(NO3)2·4H2O]常用于电子、仪表及冶金工业。一种利用CaO制备Ca(NO3)2·4H2O的流程如下:
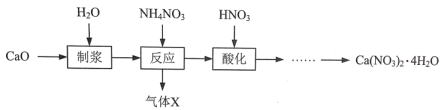
(1)“制浆”过程中发生反应的化学方程式是_________。
(2)“气体X”的化学式是_________ ,生成气体X发生反应的化学方程式是_________。
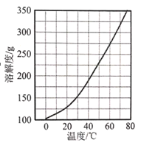
(3)Ca(NO3)2·4H2O的溶解度随温度变化的曲线如图所示,“酸化”后制取Ca(NO3)2·4H2O的操作主要包括加热浓缩、___、 过滤、洗涤、干燥。实验室过滤操作必须用到的玻璃仪器有烧杯、玻璃棒和 ____ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20mL0.1 mol/L Na2CO3溶液中逐滴加入0.1 mol/LHCl溶液40mL,溶液中含碳元素的各种微粒(CO2逸出未画出)的物质的量分数随溶液pH变化的部分情况如图所示,下列说法错误的是( )

A.在同一溶液中,H2CO3、HCO3-、CO32-不能大量共存
B.已知在25℃,CO32-的水解平衡常数Kh1=2×10-4,当溶液的pH=10时,溶液中c(HCO3-):c(CO32-)=2:1
C.pH=7时溶液中各种离子其物质的量浓度的大小关系是c(Na+)>c(HCO3-)>c(Cl-)>c(H+)=c(OH-)>c(CO32-)
D.当混合液pH≈6时,开始放出CO2气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫代硫酸钠俗称大苏打,是一种重要的化工产品,某兴趣小组设计以下装置(部分夹持装置省略)制备硫代硫酸钠晶体(Na2S2O3·5H2O):
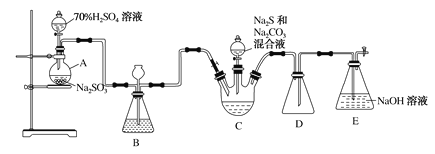
回答下列问题:
(1)仪器A的名称是____________,装置D的作用是____________。
(2)装置C中反应生成Na2S2O3和CO2,用化学方程式表示该反应________。
(3)以下实验步骤最合理的顺序是________(填序号)。
①按图示往各仪器中加入试剂
②打开C中分液漏斗旋塞,向三颈烧瓶内加入Na2S与Na2CO3的混合溶液
③连接装置并检查装置气密性
④向A中滴加70% H2SO4溶液
⑤取出C中混合物,经一系列操作得到产品
(4)装置E为尾气吸收装置,实验结束后装置E中的溶质有NaOH、Na2CO3、Na2SO3,还可能有________(填化学式),设计实验证明该物质的存在________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烃的分子式为C8H10,它滴入溴水中不能使溴水因反应而褪色,但它滴入酸性高锰酸钾溶液却能使其褪色.该有机物苯环上的一氯代物有2种,则该烃是( )
A. 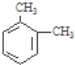 B.
B. ![]() C.
C. ![]() D.
D. 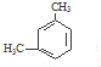
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质的类别和核心元素的化合价是研究物质性质的两个角度。请根据图所示回答下列问题:

(1)X与Y反应可生成淡黄色固体,反应的化学方程式____________________。
(2)欲制备Na2S2O3,从氧化还原角度分析,下列选项中合理的反应物是______(填序号)。
a.Na2SO3与S b.Na2S与S
c.SO2与Na2SO4 d.Na2SO3与Na2SO4
(3)7.7g锌镁合金与一定量浓硫酸恰好完全反应,生成SO2与H2的混合气体3.36L(标准状况),反应中转移的电子的物质的量为___________。
(4)处理SO2废气的一种工艺如图所示:
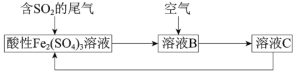
①SO2和酸性Fe2(SO4)3溶液反应的离子方程式是________________________。
②溶液B与空气发生反应生成溶液C,其中氧化剂是______________。
③推断Fe3+、O2和SO42-的氧化性由强到弱的顺序是______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com