
对下列实验操作和事实的解释正确的是
A.某学生用pH试纸测新制氯水的pH值,先变红后褪色,是因为Cl2有强氧化性
B.向氯水中加入碳酸氢钠粉末,有气泡产生,说明氯水中含有H+
C.配制一定物质的量浓度的溶液发现浓度偏低,可能由于配制溶液所用的容量瓶事先未干燥
D.将铜片放入浓硫酸中,无明显实验现象,说明铜在冷的浓硫酸中发生钝化
科目:高中化学 来源:2015届山东省济宁市高三10月阶段测试化学试卷(解析版) 题型:选择题
三氟化氮(NF3)是微电子工业中优良的等离子刻蚀气体,它在潮湿的环境中能发生反应:
3NF3+5H2O=2NO+HNO3+9HF。下列有关说法正确的是( )
A.NF3是氧化剂,H2O是还原剂
B.若生成0.2 mol HNO3,则转移0.2 mol电子
C.还原剂与氧化剂的物质的量之比为2∶1
D.NF3在潮湿的空气中泄漏会产生红棕色气体
查看答案和解析>>
科目:高中化学 来源:2015届山东省高三上学期第一次(10月)检测化学试卷(解析版) 题型:实验题
(12分)用质量分数为36.5%的盐酸(密度为1.16 g·cm-3)配制1 mol·L-1的稀盐酸。现实验室仅需要这种盐酸220 mL,试回答下列问题:
(1)配制稀盐酸时,应选用容量为________mL的容量瓶。
(2)经计算需要________mL浓盐酸,在量取时宜选用下列量筒中的________。
A.5 mL B.10 mL C.25 mL D.50 mL
(3)在量取浓盐酸后,进行了下列操作:
①等稀释的盐酸的温度与室温一致后,沿玻璃棒注入250 mL容量瓶中。
②往容量瓶中小心加蒸馏水至液面离容量瓶刻度线1~2 cm时,改用胶头滴管加蒸馏水,使溶液的液面与瓶颈的刻度标线相切。
③在盛盐酸的烧杯中注入蒸馏水,并用玻璃棒搅动,使其混合均匀。
④用蒸馏水洗涤烧杯和玻璃棒2至3次,并将洗涤液全部注入容量瓶。
上述操作中,正确的顺序是(填序号)________ 。
(4)在上述配制过程中,用刚刚洗涤洁净的量筒来量取浓盐酸,其配制的稀盐酸浓度是________(填“偏高”、“偏低”或“无影响”)。若未用蒸馏水洗涤烧杯内壁或未将洗涤液注入容量瓶,则配制的稀盐酸浓度是________(填“偏高”、“偏低”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源:2015届山东省高三上学期第二次检测化学试试卷(解析版) 题型:填空题
雾霾严重影响人们的生活与健康。某地区的雾霾中可能含有如下可溶性无机离子:Na+、NH4+、Mg2+、Fe3+、SO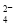 、NO
、NO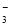 、CO
、CO 、Cl
、Cl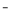 。某同学收集了该地区的雾霾,经必要的预处理后获得试样溶液,设计并完成了如下的实验:
。某同学收集了该地区的雾霾,经必要的预处理后获得试样溶液,设计并完成了如下的实验:
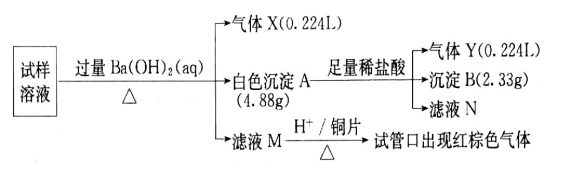
回答下列问题:(注明:白色沉淀A4.88g改为4.30g)
(1)检验气体X通常使用的试剂是______________________;
(2)沉淀B是_________,在沉淀A中加入足量稀盐酸后,溶解的沉淀是_________;
(3)试样中肯定不存在的离子是___________,不能确定是否存在的离子是______;
(4)滤液M在酸性条件下与铜片的反应中,还原产物是________________________。
(5)将实验中得到的气体Y全部通入10mL1.2mol·L 的氢氧化钠溶液中,所得溶液中含有阴离子主要有________________________________________。
的氢氧化钠溶液中,所得溶液中含有阴离子主要有________________________________________。
查看答案和解析>>
科目:高中化学 来源:2015届山东省高三上学期第二次检测化学试试卷(解析版) 题型:选择题
反应①、②分别是从海藻灰和某种矿石中提取碘的主要反应:
①2NaI+MnO2+3H2SO4==2NaHSO4+MnsO4+2H2O+I2
②2NaIO3+5NaHSO3==2Na2SO4+3NaHSO4+H2O+I2
下列说法正确的是
A.两个反应中NaHSO4均为氧化产物
B.碘元素在反应①中被还原,在反应②中被氧化
C.氧化性:MnO2>SO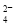 >IO
>IO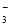 >I2
>I2
D.反应①、②中生成等量的I2时转移电子数比为1:5
查看答案和解析>>
科目:高中化学 来源:2015届山东省高三上学期第二次检测化学试试卷(解析版) 题型:选择题
下列叙述正确的是
A.非金属氧化物一定不是碱性氧化物
B.HCl、H2S、NH3都是电解质
C.漏斗、蒸馏烧瓶、分液漏斗、滴定管等仪器常用于物质分离
D.Fe(OH)3、FeCl2、CuS都不能直接用化合反应制备
查看答案和解析>>
科目:高中化学 来源:2015届山东省高三第一次学情调查化学试卷(解析版) 题型:填空题
(8分)肼(N2H4)是火箭发射常用的燃料。一种以肼(N2H4)为燃料的电池装置如图所示。 该燃料电池的电极材料采用多孔导电材料,以提高电极反应物在电极表面的吸附量,并使它们与电解质溶液充分接触,以空气中的氧气作为氧化剂,KOH溶液作为电解质。
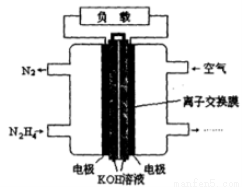
(1)负极上发生的电极反应为_________________;
(2)电池工作时产生的电流从_______电极经过负载后流向________电极(填“左侧”或“右侧”)。
(3)放电一段时间后,右侧溶液的pH (填“变大”或“变小”)
查看答案和解析>>
科目:高中化学 来源:2015届山东省文登市高三上学期11月月考化学试卷(B卷)(解析版) 题型:实验题
(18分)氯化亚铜(CuCl)常用作有机合成工业中的催化剂,是一种白色粉末;微溶于水、不溶于乙醇及稀硫酸。下图是工业上用印刷电路的蚀刻液的废液(含Fe3+、Cu2+、Fe2+、Cl-)生产CuCl的流程:
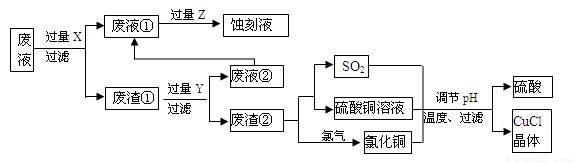
按要求回答下列问题:
(1)废液①的主要含有的金属阳离子是_____(填化学符号,下同);废渣①的主要含有的物质是________;Y为_______。
(2)检验Z过量的方法是______________________________。
(3)写出废渣②生成二氧化硫的化学方程式___________________________。
(4)为得到纯净的CuCl晶体,可用下列_________(填序号)进行洗涤。
a.纯净水 b.乙醇 c.稀硫酸 d.氯化铜溶液
(5)生产过程中调节溶液的pH不能过大的原因是____________________________。
(6)写出产生CuCl的离子方程式___________________________________________。
(7)氯化亚铜的定量分析:
①称取样品0.25g加入10ml过量的FeCl3溶液250ml锥形瓶中,不断摇动;
②待样品溶解后,加水50ml和2滴指示剂;
③立即用0.10 mol·L-1硫酸铈标准溶液滴至绿色出现为终点;
④重复三次,消耗硫酸铈溶液平均体积为25.00mL。
已知:CuCl的分子式量为99;CuCl + FeCl3 =CuCl2 + FeCl2;Fe2+ + Ce4+ = Fe3+ + Ce3+。则CuCl的纯度为____________。
查看答案和解析>>
科目:高中化学 来源:2015届山东省德州市高三10月月考化学试卷(解析版) 题型:填空题
(9分)某化学兴趣小组用含有铝、铁、铜的合金制取纯净的氯化铝溶液、绿矾晶体(FeSO4·7H2O)和胆矾晶体,以探索工业废料的再利用。其实验方案如下:试回答下列问题:
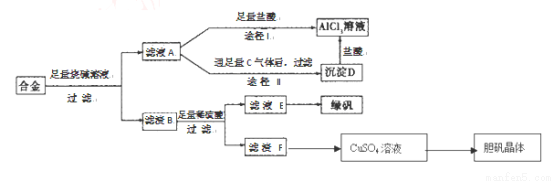
(1)器材已有:滤纸、铁架台、铁圈和烧杯,还要补充的玻璃仪器是(填名称) 。
(2)由滤液A制得AlCl3溶液有途径I和Ⅱ两条,你认为合理的是____________。
写出A经途径Ⅱ生成D的离子方程式 。
(3)从滤液E中硫酸得到绿矾晶体的实验操作是 。
(4)写出用滤渣F制备CuSO4溶液的化学方程式(要求节约,环保)
(5)有同学提出可将方案中最初溶解合金的烧碱改用盐酸,重新设计方案,也能制得三种物质,你认为后者的方案是否更合理 ,理由是
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com