
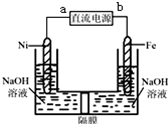
 Na2FeO4是一种既能杀菌、消毒,又能絮凝净水的水处理剂,其电解制法如图所示,请根据图示分析:电解过程中的电池反应为Fe+2OH-+2H2O $\frac{\underline{\;电解\;}}{\;}$FeO42-+3H2↑;每转移0.6mol电子在Ni电极上产生的气体在标况下的体积为6.72L;隔膜用阳离子交换膜(只允许阳离子通过)还是阴离子交换膜(只允许阴离子通过)阳离子交换膜.
Na2FeO4是一种既能杀菌、消毒,又能絮凝净水的水处理剂,其电解制法如图所示,请根据图示分析:电解过程中的电池反应为Fe+2OH-+2H2O $\frac{\underline{\;电解\;}}{\;}$FeO42-+3H2↑;每转移0.6mol电子在Ni电极上产生的气体在标况下的体积为6.72L;隔膜用阳离子交换膜(只允许阳离子通过)还是阴离子交换膜(只允许阴离子通过)阳离子交换膜. 分析 利用电解法制备Na2FeO4,Fe作阳极,碱性条件下Fe失电子转化为FeO42-离子,阳极电极反应式为:Fe+8OH--6e-=FeO42-+4H2O,Ni为阴极,发生还原反应,氢离子放电生成氢气,阴极电极反应式为:6H2O+6e-=3H2↑+6OH-,FeO42-离子氧化性很强,容易在阴极被还原,需要用用阳离子交换膜,防止生成的FeO42-离子在阴极被还原;
根据电子转移守恒,计算生成氢气的物质的量,再根据V=nVm计算氢气体积.
解答 解:利用电解法制备Na2FeO4,Fe作阳极,碱性条件下Fe失电子转化为FeO42-离子,阳极电极反应式为:Fe+8OH--6e-=FeO42-+4H2O,Ni为阴极,发生还原反应,氢离子放电生成氢气,阴极电极反应式为:6H2O+6e-=3H2↑+6OH-,所以电池反应式为:Fe+2OH-+2H2O $\frac{\underline{\;电解\;}}{\;}$FeO42-+3H2↑;
根据电子转移守恒,生成氢气的物质的量为$\frac{0.6mol}{2}$=0.3mol,标况下氢气体积为0.3mol×22.4L/mol=6.72L;
FeO42-离子氧化性很强,容易在阴极被还原,需要用用阳离子交换膜,防止生成的FeO42-离子在阴极被还原,
故答案为:Fe+2OH-+2H2O $\frac{\underline{\;电解\;}}{\;}$FeO42-+3H2↑;6.72L;阳离子交换膜.
点评 本题考查电解原理应用,根据装置图判断两极,结合高铁酸钠具有强氧化性分析,侧重考查学生知识迁移应用,是对学生综合能力的考查,难度中等.


科目:高中化学 来源: 题型:解答题
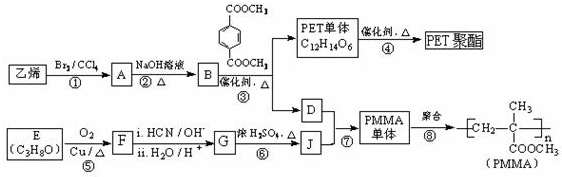
 (R、R′代表烃基)
(R、R′代表烃基) .
.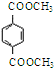 的同分异构体中满足下列条件的共有5种,其中核磁共振氢谱有4组峰,且峰面积之比为1:1:1:2的是
的同分异构体中满足下列条件的共有5种,其中核磁共振氢谱有4组峰,且峰面积之比为1:1:1:2的是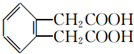 (填结构简式).
(填结构简式).查看答案和解析>>
科目:高中化学 来源:2016-2017学年山东省高一上10月月考化学试卷(解析版) 题型:选择题
能够用来鉴别BaCl2、NaCl、Na2CO3三种物质的试剂是
A.AgNO3溶液 B.稀硫酸 C.稀盐酸 D.稀硝酸
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江西省高二上第一次月考化学卷(解析版) 题型:选择题
用已知浓度的盐酸测定未知浓度的NaOH溶液的物质的量浓度,进行酸碱中和滴定时,无论是酸往碱中滴还是碱往酸中滴,下列操作都会使测定结果偏低的是(锥形瓶中溶液用滴定管量取)
A. 酸式滴定管未用标准盐酸润洗 B. 滴定过程中不慎有液体溅出
C. 滴定前仰视读数,滴定后读数正确 D. 碱式滴定管未用待测液润洗
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江西省高二上第一次月考化学卷(解析版) 题型:选择题
下列热化学方程式书写正确的是(ΔH的绝对值均正确)( )
A.Fe2O3+3CO=2Fe+3CO2ΔH=-24.8 kJ•mol-1(反应热)
B.CH3OH(g)+1/2O2(g)=CO2(g)+2H2(g) ΔH=-192.9 kJ•mol-1(反应热)
C.C4H10(g)+13/2O2(g)=4CO2(g)+5H2O(g) ΔH=-2 658.0 kJ•mol-1(燃烧热)
D.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) ΔH=+57.3 kJ•mol-1(中和热)
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
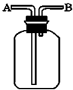 现有六种气体:H2、O2、NH3、SO2、NO2、NO.可以利用如图所示装置进行收集.
现有六种气体:H2、O2、NH3、SO2、NO2、NO.可以利用如图所示装置进行收集.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稀硝酸和氢氧化亚铁反应的离子方程式:Fe(OH)2+2H+═Fe2++2H2O | |
| B. | 少量SO2通入Ca(ClO)2溶液中:SO2+H2O+Ca2++2ClO-═CaSO3↓+2HClO | |
| C. | 在酸性溶液中,Na+、K+、MnO4-、Br-能大量共存 | |
| D. | 除去Mg2+溶液中的少量Al3+,可以采用加入足量的氢氧化钠后过滤、再加酸的方法 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
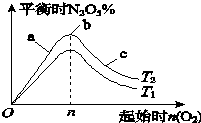 某科研小组欲研究在其他条件不变的情况下,改变起始氧气的物质的量对合成新型硝化剂反应4NO2(g)+O2(g)?2N2O5(g)△H<0的影响.
某科研小组欲研究在其他条件不变的情况下,改变起始氧气的物质的量对合成新型硝化剂反应4NO2(g)+O2(g)?2N2O5(g)△H<0的影响.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
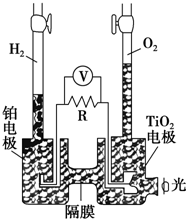 TiO2在光照射下可使水分解:2H2O$\frac{\underline{\;TiO_{2}\;}}{光}$2H2↑+O2↑,该过程类似植物的光合作用.如图是光照射下TiO2分解水的装置示意图,电解质溶液为稀硫酸.下列叙述正确的是( )
TiO2在光照射下可使水分解:2H2O$\frac{\underline{\;TiO_{2}\;}}{光}$2H2↑+O2↑,该过程类似植物的光合作用.如图是光照射下TiO2分解水的装置示意图,电解质溶液为稀硫酸.下列叙述正确的是( )| A. | 该装置只能将光能转化为电能 | |
| B. | TiO2电极上发生的反应为:2H++2e-═H2↑ | |
| C. | 该装置工作时,电流由TiO2电极经R流向铂电极 | |
| D. | 该装置工作时,TiO2电极附近溶液的pH变小 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com