
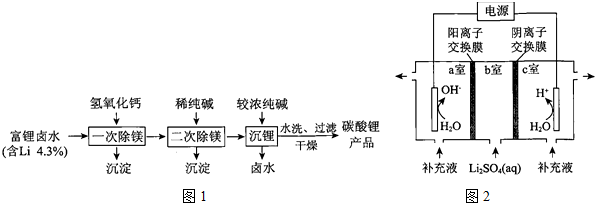
分析 (1)锂在元素周期表中的位置是:第二周期IA族;
(2)利用金属与水反应剧烈程度等判断金属性强弱;
(3)①卤水中加入氢氧化钙将大部分镁离子转化为氢氧化镁沉淀,再加入稀碳酸钠溶液,溶液中镁离子、钙离子转化为沉淀;
②二次除镁后过滤分离,滤液中加入浓碳酸钠溶液,使溶液中Li+转化为碳酸锂沉淀,“沉锂”和“二次除镁”时所用纯碱的浓度不同,是由于碳酸锂的溶解度大于碳酸镁、碳酸钙的溶解度;
(4)①碳酸锂与硫酸反应生成硫酸锂、二氧化碳与水;
②由水的生成物可知,a室为阴极室,c为阳极室,a室中水放电生成氢气与碱,b室中锂离子经过阳离子交换膜进入a室,最终得到LiOH,c室中水放电生成氧气与氢离子,硫酸根离子经过阴离子交换膜加入c室,最终得到硫酸;
③c室中生成的硫酸可以溶解碳酸锂.
解答 解:(1)锂在元素周期表中的位置是:第二周期IA族,故答案为:第二周期IA族;
(2)Na与Li分别与水反应,Na与水的反应更剧烈,证明锂的金属性弱于钠,
故答案为:Na与Li分别与水反应,Na与水的反应更剧烈;
(3)①卤水中加入氢氧化钙将大部分镁离子转化为氢氧化镁沉淀,再加入稀碳酸钠溶液,溶液中镁离子、钙离子转化为沉淀,“二次除镁”所得的沉淀中主要有碱式碳酸镁和碳酸钙,
故答案为:碳酸钙;
②二次除镁后过滤分离,滤液中加入浓碳酸钠溶液,使溶液中Li+转化为碳酸锂沉淀,“沉锂”和“二次除镁”时所用纯碱的浓度不同,是由于碳酸锂的溶解度大于碳酸镁、碳酸钙的溶解度,使Li+沉淀需要增大CO32-的浓度,
故答案为:碳酸锂的溶解度大于碳酸镁、碳酸钙的溶解度,使Li+沉淀需要增大CO32-的浓度;
(4)①碳酸锂与硫酸反应生成硫酸锂、二氧化碳与水,反应离子方程式为:Li2CO3+2H+=Li++CO2↑+H2O,
故答案为:Li2CO3+2H+=Li++CO2↑+H2O;
②由水的生成物可知,a室为阴极室,c为阳极室,a室中水放电发生反应:2H2O+2e-=H2↑+2OH-,b室中锂离子经过阳离子交换膜进入a室,最终得到LiOH,c室中水放电生成氧气与氢离子,硫酸根离子经过阴离子交换膜加入c室,最终得到硫酸;
故答案为:a室中发生反应:2H2O+2e-=H2↑+2OH-,b室中锂离子经过阳离子交换膜进入a室,a室中最终产物为LiOH与氢气;
③c室中生成的H2SO4可以溶解碳酸锂,进行循环利用,
故答案为:H2SO4.
点评 本题考查物质制备工艺流程,是化学与技术综合运用,涉及海水资源的开发与利用、物质的分离提纯、电解原理应用等,侧重考查学生对原理的分析理解,难度中等.


 金版课堂课时训练系列答案
金版课堂课时训练系列答案 单元全能练考卷系列答案
单元全能练考卷系列答案 新黄冈兵法密卷系列答案
新黄冈兵法密卷系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 元素X基态原子核外电子数为29,元素Y位于X的前一周期且最外层电子数为1,元素Z基态原子3p轨道上有4个电子,元素P原子最外层电子数是其内层电子数的3倍,元素Q基态原子2p半充满.请回答下列问题:
元素X基态原子核外电子数为29,元素Y位于X的前一周期且最外层电子数为1,元素Z基态原子3p轨道上有4个电子,元素P原子最外层电子数是其内层电子数的3倍,元素Q基态原子2p半充满.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素代号 | A | B | C | D | E |
| 原子半径/nm | 0.16 | 0.143 | 0.102 | 0.099 | 0.074 |
| 主要化合价 | +2 | +3 | +6、-2 | -1 | -2 |
 .B的氧化物溶于氢氧化钠溶液的方程式为Al2O3+2NaOH+3=2NaAlO2+H2O;
.B的氧化物溶于氢氧化钠溶液的方程式为Al2O3+2NaOH+3=2NaAlO2+H2O;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com