
| A、Cl2 |
| B、KMnO4 |
| C、FeCl3 |
| D、HCl |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、锌和稀硝酸反应制备氢气 |
| B、用铁粉、溴水和苯制取溴苯 |
| C、铝放入冷的浓硝酸中制取二氧化氮 |
| D、用亚硫酸钠与硫酸制取二氧化硫 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Q1<Q2 |
| B、石墨不如金刚石稳定 |
| C、质量相等的石墨与金刚石,石墨具有的能量比金刚石低 |
| D、质量相等的石墨与金刚石完全燃烧,生成的二氧化碳一样多 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、制备高铁酸钾用ClO-做还原剂 |
| B、制备高铁酸钾时1mol Fe(OH)3得到3 mol 电子 |
| C、用高铁酸钾处理水时,其氧化产物能水解产生具有强吸附能力的胶体 |
| D、高铁酸钾中铁的化合价为+6 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素代号 | X | Y | Z | W | N |
| 原子半径/nm | 0.186 | 0.074 | 0.102 | 0.099 | 0.160 |
| 主要化合价 | +1 | -2 | -2、+6 | +7、-1 | +2 |
| A、常温下单质与水反应速率:X>N |
| B、最高价氧化物对应水化物酸性:W>Z |
| C、X 与W形成的化合物是共价化合物 |
| D、X和Y的单质在一定条件下反应可生成一种淡黄色的固体化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、含氧酸的酸性H3ZO4>H2YO4>HXO4 |
| B、非金属性Z>Y>X |
| C、原子半径Z>Y>X |
| D、气态氢化物的稳定性按X、Y、Z的顺序增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:
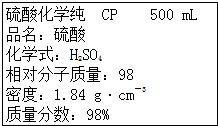
| A、该硫酸的浓度为9.2 mol?L-1 | ||
| B、配制200 mL 4.6 mol?L-1的稀H2SO4需该H2SO4 50 mL | ||
| C、该硫酸与等体积水混合质量分数变为49% | ||
D、取该硫酸100 mL,则浓度变为原来的
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、直径在1~100 nm之间的粒子称为胶体 |
| B、胶体属于电解质溶液 |
| C、胶体粒子很小,可以透过半透膜 |
| D、利用丁达尔效应可以区别溶液与胶体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com