
 太阳能的开发利用在新能源研究中占据重要地位,单晶硅太阳能电池片在加工时,一般掺杂微量的铜、锎、硼、镓、硒等.回答下列问題:
太阳能的开发利用在新能源研究中占据重要地位,单晶硅太阳能电池片在加工时,一般掺杂微量的铜、锎、硼、镓、硒等.回答下列问題:分析 (1)Cu元素原子核外电子排布式为1s22s22p63s23p63d104s1,4s、3d能级各失去1个电子形成Cu2+;亚铜离子价电子排布式为3d10,亚铜离子核外电子处于稳定的全充满状态;
(2)阴离子处于晶胞的体心、面心、顶点与棱上,利用均摊法计算;
(3)F的电负性比N大,N-F成键电子对偏向F,导致NF3中氮原子核对其孤电子对的吸引能力增强,难以形成配位键;
(4)(SCN)2的结构式为N≡C-S-S-C≡N,单键为σ键,三键含有1个σ键、2个π键;H-N=C=S分子间有氢键,沸点高于H-S-C≡N;
(5)BF3•NH3中B原子形成4个σ键、没有孤对电子,杂化轨道数目为4;B原子含有空轨道,N原子含有孤对电子;
(6)六方氮化硼晶体结构与石墨晶体相似,层间相互作用为分子间作用力;
在金刚石的晶胞中含有的碳原子数为4+8×$\frac{1}{8}$+6×$\frac{1}{2}$=8,立方氮化硼与金刚石相似,所以氮化硼晶胞中硼原子和氮原子的数目各有4个,计算晶胞质量,再根据ρ=$\frac{m}{V}$计算立方氮化硼的密度.
解答 解:(1)Cu元素原子核外电子排布式为1s22s22p63s23p63d104s1,4s、3d能级各失去1个电子形成Cu2+,铜离子核外电子排布为:1s22s22p63s23p63d9,亚铜离子价电子排布式为3d10,亚铜离子核外电子处于稳定的全充满状态,高温下Cu2O比CuO更稳定,
故答案为:1s22s22p63s23p63d9;亚铜离子价电子排布式为3d10,亚铜离子核外电子处于稳定的全充满状态;
(2)阴离子处于晶胞的体心、面心、顶点与棱上,晶胞中阴离子数目为1+8×$\frac{1}{8}$+2×$\frac{1}{2}$+4×$\frac{1}{4}$=4,
故答案为:4;
(3)F的电负性比N大,N-F成键电子对偏向F,导致NF3中氮原子核对其孤电子对的吸引能力增强,难以形成配位键,故NF3不易与Cu2+形成配离子,
故答案为:F的电负性比N大,N-F成键电子对偏向F,导致NF3中氮原子核对其孤电子对的吸引能力增强,难以形成配位键;
(4)(SCN)2的结构式为N≡C-S-S-C≡N,单键为σ键,三键含有1个σ键、2个π键,1mol(SCN)2中含有π键的数目为4NA,异硫氰酸分子间可形成氢键,而硫氰酸不能,故异硫氰酸的沸点较高,
故答案为:4NA;异硫氰酸分子间可形成氢键,而硫氰酸不能;
(5)BF3•NH3中B原子形成4个σ键、没有孤对电子,杂化轨道数目为4,B原子采取sp3杂化;B原子含有空轨道,N原子含有孤对电子,形成配位键中N原子提供孤对电子,
故答案为:sp3;孤对电子;
(6)六方氮化硼晶体结构与石墨晶体相似,层间相互作用为分子间作用力;
在金刚石的晶胞中含有的碳原子数为4+8×$\frac{1}{8}$+6×$\frac{1}{2}$=8,立方氮化硼与金刚石相似,所以氮化硼晶胞中硼原子和氮原子的数目各有4个,晶胞质量为4×$\frac{25}{{N}_{A}}$g,晶胞边长为361.5pm,则氮化硼的密度为4×$\frac{25}{{N}_{A}}$g÷(361.5×10-10cm)3=$\frac{4×25}{{N}_{A}×(361.5×1{0}^{-10})^{3}}$g•cmˉ3,
故答案为:分子间作用力;$\frac{4×25}{{N}_{A}×(361.5×1{0}^{-10})^{3}}$.
点评 本题是对物质结构与性质的考查,涉及核外电子排布、晶胞结构与计算、配合物、杂化方式、化学键等,(6)中密度计算为易错点,注意识记中学常见晶胞结构,难度中等.


 中考解读考点精练系列答案
中考解读考点精练系列答案科目:高中化学 来源: 题型:解答题
 铝和硫的单质及其化合物在工农业生产和生活中有重要的作用.
铝和硫的单质及其化合物在工农业生产和生活中有重要的作用.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 根据弱酸越稀越电离的规律,0.2mol•L-1 CH3COOH的pH值比0.1mol•L-1 CH3COOH的 pH值大 | |
| B. | 根据主族元素最高正化合价与族序数的关系,推出卤族元素最高正价都是+7 | |
| C. | 根据溶液的pH与溶液酸碱性的关系,推出pH=6.8的溶液一定显酸性 | |
| D. | 根据较强酸可以制取较弱酸的规律,推出CO2通入NaClO溶液中能生成HClO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
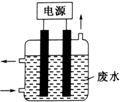 用如图所示装置除去含CN-、Cl-废水中的CN-时,控制溶液PH为9~10,阳极产生的ClO-将CN-氧化为两种无污染的气体,下列说法不正确的是( )
用如图所示装置除去含CN-、Cl-废水中的CN-时,控制溶液PH为9~10,阳极产生的ClO-将CN-氧化为两种无污染的气体,下列说法不正确的是( )| A. | ClO-将CN-氧化过程中,每消耗1molCN-转移10mol电子 | |
| B. | 阳极的电极反应式为:Cl-+2OH--2e-═ClO-+H2O | |
| C. | 阴极的电极反应式为:2H2O+2e-═H2↑+2OH- | |
| D. | 在电解过程中,废水中CN-和Cl-均移向阳极 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
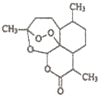 中国药学家屠呦呦因最早发现并提纯抗疟新药青蒿素而获得2015年度诺贝尔生理学或医学奖.已知青蒿素可从与青蒿同属的黄花蒿中提取,其结构如图所示,下列有关青蒿素说法不正确的是( )
中国药学家屠呦呦因最早发现并提纯抗疟新药青蒿素而获得2015年度诺贝尔生理学或医学奖.已知青蒿素可从与青蒿同属的黄花蒿中提取,其结构如图所示,下列有关青蒿素说法不正确的是( )| A. | 化学式为C15H20O5 | |
| B. | 能与NaOH溶液发生反应 | |
| C. | 与H2O2含有相似结构,具有杀菌作用 | |
| D. | 提取方法主要是低温萃取 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氧化铁溶于氢碘酸中:2Fe(OH)3+6H++2I-═2Fe2++I2+6H2O | |
| B. | 向Na2SiO3溶液中通入过量SO2:SiO32-+SO2+H2O═H2SiO3↓+SO32- | |
| C. | 向0.3mol/LNaClO溶液中滴加等体积的0.2mol/LNaHSO3溶液:2HSO3-+4ClO-═2SO42-+2Cl-+2HClO | |
| D. | 向碘化亚铁溶液中滴加溴的四氯化碳溶液2Br2+2Fe2++2I-═I2+4Br-+2Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 室温下测定等浓度氨水和NaOH溶液的pH,比较氨水和NaOH碱性强弱 | |
| B. | 将氨水缓慢滴入AlCl3溶液中,研究Al(OH)3的两性 | |
| C. | 将蘸有浓氨水和浓硫酸的玻璃棒靠近,观察到白烟 | |
| D. | 加热除去NH4Cl中的少量NaHC03 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
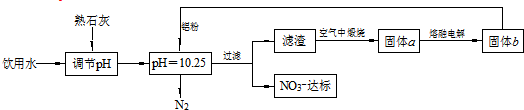
| A. | 该方案在调节pH时,若pH过大或过小都会造成Al的利用率降低 | |
| B. | 为了降低能耗,工业上往往用AlCl3代替固体a来制备固体b | |
| C. | 用熟石灰调节PH主要原因是价格便宜且引入的Ca2+对人体无害 | |
| D. | 在加入铝粉的反应中,氧化产物和还原产物的物质的量之比为10:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com