
| 点燃 |
| 点燃 |
| 点燃 |
| 点燃 |
| 点燃 |
| △ |
| △ |
| 点燃 |
| 点燃 |
| △ |


 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案科目:高中化学 来源:志鸿系列必修一训练化学苏教版 苏教版 题型:058
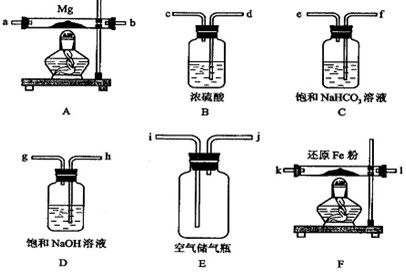
镁是一种很活泼的金属,常用作脱硫剂、脱氧剂.在电子工业中利用镁制取硅的反应为2Mg+SiO2![]() 2MgO+Si(玻璃中含有一定量的二氧化硅),同时有副反应发生:2Mg+Si
2MgO+Si(玻璃中含有一定量的二氧化硅),同时有副反应发生:2Mg+Si![]() Mg2Si.Mg2Si遇盐酸迅速反应生成SiH4(硅烷).SiH4在常温下是一种不稳定、易分解的气体.
Mg2Si.Mg2Si遇盐酸迅速反应生成SiH4(硅烷).SiH4在常温下是一种不稳定、易分解的气体.
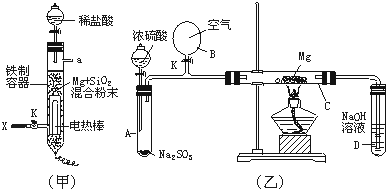
(1)图(甲)是进行Mg与SiO2反应的实验装置.
Ⅰ.由于O2的存在对该实验有较大影响,实验中应通入X气体作为保护气.X气体应选用①CO2、②N2、③H2中的________.
Ⅱ.实验开始时,必须先通入X的气体,再接通电源加热反应物.其理由是________;当反应引发后,切断电源,反应能继续进行,其原因是________.
Ⅲ.反应结束时,待冷却至常温后,关闭K,从分液漏斗处加入稀盐酸,可观察到导管口a处有闪亮的火星.据此现象可推知________在空气中能自燃.
(2)图(乙)所示装置进行的实验如下:先关闭K,使A中反应进行;加热玻璃管C,可观察到C管中发出耀眼白光,产生白烟,管壁上附着有淡黄色物质.实验完成后,将C管中固体全部加入盐酸中,有臭鸡蛋气味的气体生成.
Ⅰ.C中的Mg应放在不锈钢垫片上而不能直接接触管壁,这是因为________.
Ⅱ.停止实验时,先打开K,再停止滴加浓硫酸并熄灭酒精灯.橡胶气胆B在实验中的作用是________.
Ⅲ.C中全部反应产物有________、________、________(填化学式).
查看答案和解析>>
科目:高中化学 来源: 题型:
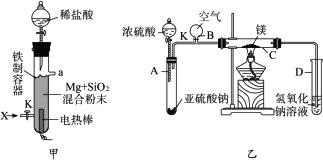
(1)图(甲)是进行Mg与SiO2反应的实验装置。
Ⅰ.由于O2的存在对该实验有较大影响,实验中应通入X气体作为保护气。X气体应选用①CO2 、②N2 、③H2 中的________________。
Ⅱ.实验开始时,必须先通入X的气体,再接通电源加热反应物。其理由是_____________________________;当反应引发后,切断电源,反应能继续进行,其原因是_____________________________。
Ⅲ.反应结束时,待冷却至常温后,关闭K,从分液漏斗处加入稀盐酸,可观察到导管口a处有闪亮的火星。据此现象可推知____________________在空气中能自燃。
(2)图(乙)所示装置进行的实验如下:先关闭K,使A中反应进行;加热玻璃管C,可观察到C管中发出耀眼白光,产生白烟,管壁上附着有淡黄色物质。实验完成后,将C管中固体全部加入盐酸中,有臭鸡蛋气味的气体生成。
Ⅰ.C中的Mg应放在不锈钢垫片上而不能直接接触管壁,这是因为______________________。
Ⅱ.停止实验时,先打开K,再停止滴加浓硫酸并熄灭酒精灯。橡胶气胆B在实验中的作用是_______________________________。
Ⅲ.C中全部反应产物有___________、___________、___________(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
镁是一种很活泼的金属,常用作脱硫剂、脱氧剂。在电子工业中利用镁制取硅的反应为2Mg+SiO2![]() 2MgO+Si(玻璃中含有一定量的二氧化硅),同时有副反应发生:2Mg+Si
2MgO+Si(玻璃中含有一定量的二氧化硅),同时有副反应发生:2Mg+Si![]() Mg2Si。Mg2Si遇盐酸迅速反应生成SiH4(硅烷)。SiH4在常温下是一种不稳定、易分解的气体。
Mg2Si。Mg2Si遇盐酸迅速反应生成SiH4(硅烷)。SiH4在常温下是一种不稳定、易分解的气体。

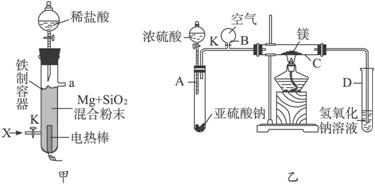
(1)图(甲)是进行Mg与SiO2反应的实验装置。
Ⅰ.由于O2的存在对该实验有较大影响,实验中应通入X气体作为保护气。X气体应选用①CO2 、②N2 、③H2 中的________________。
Ⅱ.实验开始时,必须先通入X的气体,再接通电源加热反应物。其理由是_____________________________;当反应引发后,切断电源,反应能继续进行,其原因是_____________________________。
Ⅲ.反应结束时,待冷却至常温后,关闭K,从分液漏斗处加入稀盐酸,可观察到导管口a处有闪亮的火星。据此现象可推知____________________在空气中能自燃。
(2)图(乙)所示装置进行的实验如下:先关闭K,使A中反应进行;加热玻璃管C,可观察到C管中发出耀眼白光,产生白烟,管壁上附着有淡黄色物质。实验完成后,将C管中固体全部加入盐酸中,有臭鸡蛋气味的气体生成。
Ⅰ.C中的Mg应放在不锈钢垫片上而不能直接接触管壁,这是因为______________________。
Ⅱ.停止实验时,先打开K,再停止滴加浓硫酸并熄灭酒精灯。橡胶气胆B在实验中的作用是_______________________________。
Ⅲ.C中全部反应产物有___________、___________、___________(填化学式)。
查看答案和解析>>
科目:高中化学 来源:2014届四川省高一下学期期末考试化学试卷(解析版) 题型:填空题
(14分)镁、铝是两种重要的金属,它们的单质及化合物有着各自的性质。
Ⅰ.海水中含有氯化镁,是镁的重要来源之一。从海水中制取镁,某同学设计了如下
流程步骤:

主要的步骤总结如下:①把贝壳制成石灰乳 ②往母液中加石灰乳,沉降、过滤,得到Mg(OH)2沉淀 ③将沉淀物与盐酸反应,结晶、过滤,将制得的晶体脱水得无水MgCl2
④将得到的产物熔融后电解。
(1)下列说法不正确的是__________________(填代号)
A.此法的优点之一是原料来源丰富
B.进行①②③步骤的目的是从海水中提取氯化镁
C.第④步电解法制取镁是由于镁是很活泼的金属
D.以上制取镁的过程中涉及的反应有分解反应、化合反应和置换反应
(2)步骤②不够合理,理由是
Ⅱ.(1)铝、空气、海水可组成一种电池,广泛用于制造航标灯。此电池正极的电极反应为 。
(2)铝热还原法是冶炼熔点较高的金属的一种重要方法,焊接钢轨即用到此法。将干燥的氧化铁粉末和铝粉均匀混合后放入纸漏斗中(漏斗已事先处理好),并架在铁架台上,
下面放置一个盛有沙子的蒸发皿。请写出引发铝热反应的操作及该反应的化学方程式:
操作
化学方程式 。
(3)为确定某铝热剂(氧化铁粉末和铝粉)的组成,分别进行下列实验。
若取10.7 g样品,向其中加入足量的NaOH溶液,测得生成的气体(标准状况)体积为3.36 L ,反应的化学方程式为 ,样品中铝的质量是 g。
若取10.7 g样品将其点燃,恰好完全反应,待反应产物冷却后,加入足量盐酸,测得生成的气体体积为a L,该气体与上小题中所得气体的体积比等于 ∶ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com