
| A、1molSO2(g)和0.5molO2(g)置于密闭容器中 在一定条件下充分反应,放热98.3KJ |
| B、若升高温度,正反应速率增大,逆反应速率减小 |
| C、其他条件不变时,加入催化剂,速率一定加快 |
| D、2molSO2(g)和1molO2(g)具有的能量之和大于2molSO3(g)具有的能量 |


科目:高中化学 来源: 题型:
| A、用盐酸除金属表面的锈是物理变化,食盐水导电是化学变化 |
| B、热的饱和KNO3溶液降温析出晶体是物理变化,二硫化碳洗涤试管内壁上的硫是化学变化 |
| C、混合物:铝热剂 液氯 水玻璃 明矾 |
| D、化合物:干冰 冰水混合物 烧碱 小苏打 |
查看答案和解析>>
科目:高中化学 来源: 题型:
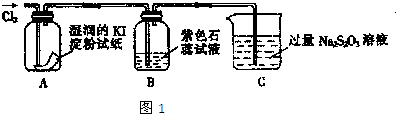
| ||
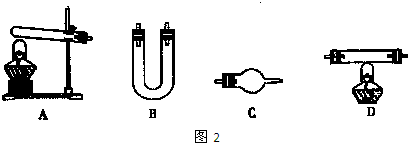
| 选用的仪器(填字母) | 加入的试剂 | 作用 |
| 反应器(或产生气体) | ||
| 氧化铜 | 使氨气与氧化铜反应 | |
| C |
查看答案和解析>>
科目:高中化学 来源: 题型:
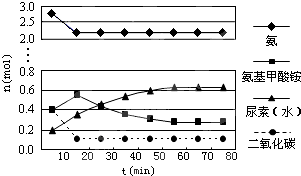
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
| A、-1641.0kJ/mol |
| B、+3081kJ/mol |
| C、+663.5kJ/mol |
| D、-2507.0kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Ba2++SO42-═BaSO4↓ |
| B、Fe+2H+═Fe2++H2↑ |
| C、Al2O3+6H+═2Al3++3H2O |
| D、HCO3-+OH-═CO32-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
A、 |
B、 |
C、 |
D、 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 11 |
| 4 |
| 1 |
| 2 |
| A、-130.3kJ?mol-1 |
| B、-1310.2kJ?mol-1 |
| C、-1179.kJ?mol-1 |
| D、-853kJ?mol-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com