
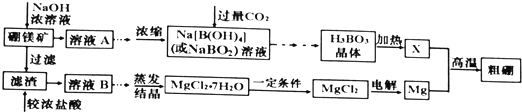
分析 I.硼镁矿主要成分为Mg2B2O5•H2O,可以看做2MgO•B2O3•H2O,含有少量杂质A12O3和Fe3O4,用浓氢氧化钠溶液溶解,B2O3、A12O3与氢氧化钠反应得到NaBO2、NaAlO2,而MgO、Fe3O4不与氢氧化钠反应,过滤得到滤渣为MgO、Fe3O4,滤液A中为NaBO2、NaAlO2及剩余的NaOH,浓缩后通入过量的二氧化碳,经过系列操作得到H3BO3,加热得到B2O3,再与Mg发生置换反应反应得到B与MgO.
滤渣与过量的浓盐酸反应得到溶液B中有MgCl2、FeCl3及未反应的HCl,加入氧化镁等调节溶液pH,使溶液中铁离子转化为氢氧化铁沉淀,再过滤除去,溶液进行蒸发结晶得到MgCl2•7H2O,在HCl氛围下加热分解得到MgCl2,以防止氯化镁水解,再电解熔融的MgCl2得到金属Mg及氯气.(1)中溶液B中含有的铁元素以Fe3+形式存在,用KSCN溶液进行检验;
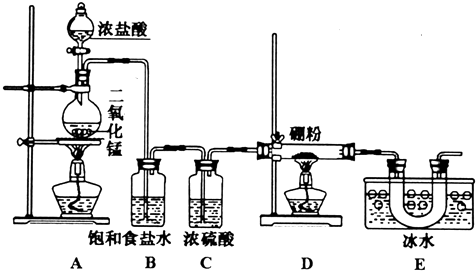
Ⅱ.BCl3在潮湿空气中易形成白雾,遇水发生水解反应,应在无水环境下进行,装置A制备氯气,制备的氯气中含有挥发出的HCl,由于B与HCl可以发生反应:2B+6HCl(g)$\frac{\underline{\;\;△\;\;}}{\;}$2BCl3+3H2↑,生成的氢气与氯气易发生爆炸,B装置吸收HCl,C装置由于干燥氯气,D装置中B与氯气反应生成BCl3,由于BCl3的沸点较低,反应得到为气态BCl3,E装置利用冰水冷却收集得到液体BCl3,由于未反应的氯气会污染环境,需要在E装置之后添加吸收氯气装置,同时防止空气中的水蒸气加入D中,防止BCl3发生水解.
解答 解:I.硼镁矿主要成分为Mg2B2O5•H2O,可以看做2MgO•B2O3•H2O,含有少量杂质A12O3和Fe3O4,用浓氢氧化钠溶液溶解,B2O3、A12O3与氢氧化钠反应得到NaBO2、NaAlO2,而MgO、Fe3O4不与氢氧化钠反应,过滤得到滤渣为MgO、Fe3O4,滤液A中为NaBO2、NaAlO2及剩余的NaOH,浓缩后通入过量的二氧化碳,经过系列操作得到H3BO3,加热得到B2O3,再与Mg发生置换反应反应得到B与MgO.
滤渣与过量的浓盐酸反应得到溶液B中有MgCl2、FeCl3及未反应的HCl,加入氧化镁等调节溶液pH,使溶液中铁离子转化为氢氧化铁沉淀,再过滤除去,溶液进行蒸发结晶得到MgCl2•7H2O,在HCl氛围下加热分解得到MgCl2,以防止氯化镁水解,再电解熔融的MgCl2得到金属Mg及氯气.
(1)中溶液B中含有的铁元素以Fe3+形式存在,用KSCN溶液进行检验,具体操作为:取少许溶液B于试管中,滴加几滴KSCN溶液,溶液变红色,说明含有Fe元素,
故答案为:取少许溶液B于试管中,滴加几滴KSCN溶液,溶液变红色,说明含有Fe元素;
(2)Mg与B2O3得到B与MgO,反应方程式为:3Mg+B2O3$\frac{\underline{\;高温\;}}{\;}$2B+3MgO,
故答案为:3Mg+B2O3$\frac{\underline{\;高温\;}}{\;}$2B+3MgO;
(3)MgCl2•7H2O在HCl氛围下加热分解得到MgCl2,以防止氯化镁水解,
故答案为:HCl氛围、加热;
Ⅱ.BCl3在潮湿空气中易形成白雾,遇水发生水解反应,应在无水环境下进行,装置A制备氯气,制备的氯气中含有挥发出的HCl,由于B与HCl可以发生反应:2B+6HCl(g)$\frac{\underline{\;\;△\;\;}}{\;}$2BCl3+3H2↑,生成的氢气与氯气易发生爆炸,B装置吸收HCl,C装置由于干燥氯气,D装置中B与氯气反应生成BCl3,由于BCl3的沸点较低,反应得到为气态BCl3,E装置利用冰水冷却收集得到液体BCl3,由于未反应的氯气会污染环境,需要在E装置之后添加吸收氯气装置,同时防止空气中的水蒸气加入D中,防止BCl3发生水解.
(4)由上述分析可知,E装置的作用是:冷却并收集BCl3,故答案为:冷却并收集BCl3;
(5)B装置吸收HCl,若去掉B装置,B与HCl可以发生反应:2B+6HCl(g)$\frac{\underline{\;\;△\;\;}}{\;}$2BCl3+3H2↑,生成的氢气与氯气易发生爆炸,
故答案为:加热时B与HCl可以发生反应:2B+6HCl(g)$\frac{\underline{\;\;△\;\;}}{\;}$2BCl3+3H2↑,生成的氢气与氯气混合易发生爆炸,
故答案为:加热时B与HCl反应生成的氢气与氯气混合易发生爆炸;
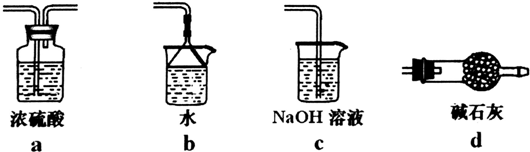
(6)由于未反应的氯气会污染环境,BCl3遇水发生水解,故需要在E装置之后添加吸收氯气装置,同时防止空气中的水蒸气加入D中,防止BCl3发生水解,
a中浓硫酸不能吸收剩余的氯气,bc均含有水,水蒸气可以进入E中,导致BCl3发生水解,d中碱石灰可以吸收氯气与空气中水蒸气,故选:d.
点评 本题考查实验制备方案,侧重考查学生对装置的分析评价、实验条件的控制等,明确原理是解题关键,是对学生综合能力的考查,注意对题目信息的提取与运用,难度中等.


 浙江之星学业水平测试系列答案
浙江之星学业水平测试系列答案 高效智能课时作业系列答案
高效智能课时作业系列答案科目:高中化学 来源: 题型:多选题

| A. | x为强酸,y为弱酸 | |
| B. | 随着稀释的进行,y的电离程度减小 | |
| C. | 稀释前x、y的物质的量浓度相等 | |
| D. | 稀释后的x、y分别分别与足量的锌反应,y放出的氢气多 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 如图,在盛有稀 H2SO4 的烧杯中放入用导线连接的电极X、Y,外电路中电子流向如图所示,关于该装置的下列说法正确的是( )
如图,在盛有稀 H2SO4 的烧杯中放入用导线连接的电极X、Y,外电路中电子流向如图所示,关于该装置的下列说法正确的是( )| A. | 外电路的电流方向为:X→外电路→Y | |
| B. | 若两电极分别为 Fe 和碳棒,则 X 为碳棒,Y 为 Fe | |
| C. | X 极上发生的是还原反应,Y 极上发生的是氧化反应 | |
| D. | 若两电极都是金属,则它们的活动性顺序为 X>Y |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 采用加热蒸发溶剂的方法可以使浓度为4 mol/L的盐酸溶液的浓度变为8 mol/L | |
| B. | 把100 g 20%的NaCl溶液跟100 g H2O混合后,NaCl溶液的质量分数是10% | |
| C. | 将2.3 g Na投入到97.7g水中充分反应,所得溶液的质量分数为4.0% | |
| D. | 已知某温度下KNO3的溶解度是31.6 g,该温度下将20 g KNO3溶解于50 g水中,充分溶解,获得溶液的质量分数是28.6% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 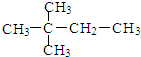 | B. |  | ||
| C. | CH3CH2CH2CH2CH3 | D. | 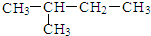 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
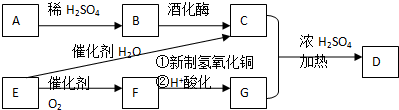
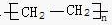 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化硫具有还原性 | |
| B. | 因为二氧化硫具有漂白性,能使品红溶液永久褪色 | |
| C. | 大气中二氧化碳浓度高时能形成酸雨 | |
| D. | 浓硫酸常用作干燥剂,因为浓硫酸具有脱水性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 混合物 | 分离、提纯方法 |
| A. | 分离苯和水 | 分液法 |
| B. | 分离乙醇和甲醇 | 蒸馏法 |
| C. | 除去乙炔中H2S气体 | 用CuSO4溶液洗气 |
| D. | 除去水中的少量苯酚 | 过滤 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com