
| A. | ③②①④ | B. | ①④②③ | C. | ④①②③ | D. | ②③①④ |
分析 氯离子的物质的量浓度与溶液体积大小无关,与溶质的浓度及化学式组成有关,据此进行解答.
解答 解:①250ml 2mol/L MgCl2溶液中,Cl-的浓度为:c(Cl-)=2mol/L×2=4mol/L;
②200mL 2.5mol/LNaCl溶液 中,Cl-的浓度为:c(Cl-)=2.5mol/L×1=2.5mol/L
③氯酸钾电离出氯酸根离子和钾离子,则100mL 5mol/L KC1O3溶液中不存在氯离子;
④500ml1mol/L AlCl3溶液中,Cl-的浓度为:c(Cl-)=1mol/L×3=3mol/L,
根据分析可知,溶液中Cl-浓度由大到小的顺序为:①④②③,
故选B.
点评 本题考查了物质的量浓度的计算,题目难度不大,明确物质的量浓度的概念及表达式即可解答,注意氯离子浓度与溶液体积大小无关,为易错点,试题培养了学生的化学计算能力.


科目:高中化学 来源: 题型:解答题
| 压强(标准大气压) | 1 | 5 | 10 | 100 |
| SO2转化率(%) | 93.5 | 96.9 | 97.8 | 99.3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
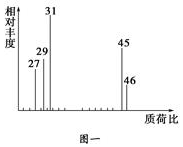
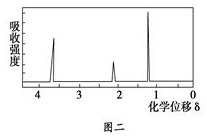
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向反应后的深蓝色溶液中加入乙醇,会有蓝色的CuSO4•5H2O晶体析出 | |
| B. | 在[Cu(NH3)4]2+离子中,Cu2+给出孤对电子,NH3提供空轨道 | |
| C. | 反应后溶液中不存在任何沉淀,所以反应前后Cu2+的数目不变 | |
| D. | 沉淀溶解后,将生成深蓝色的配合离子[Cu(NH3)4]2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
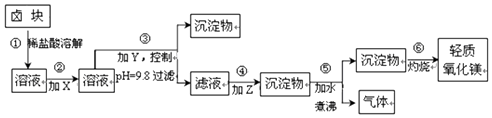
| 表1:生成氢氧化物沉淀的pH | 表2:原料价格表 | |||
| 物质 | 开始沉淀 | 沉淀完全 | 物质 | 价格(元/吨) |
| Fe(OH)3 | 2.7 | 3.7 | a.漂液(含25.2%NaClO) | 450 |
| Fe(OH)2 | 7.6 | 9.6﹡ | b.双氧水(含30%H2O2) | 2400 |
| 资*源%库Mn(OH)2 | 8.3 | 9.8 | c.烧碱(含98%NaOH) | 2100 |
| Mg(OH)2 | 9.6 | 11.1 | d.纯碱(含99.5%Na2CO3) | 600 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
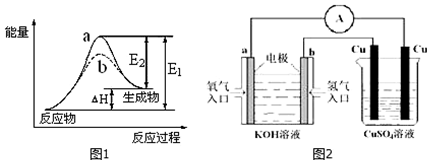
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:C>D>E>A>B | |
| B. | 常见氢化物的热稳定性:B<E | |
| C. | C可分别与A、B形成共价化合物、离子化合物 | |
| D. | 制备含D、E的二元化合物时,可能需要在无水条件下进行 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com