
小明家收藏了一张清末的铝制佛像,至今保存完好。其未被锈蚀的主要原因是( )
A.铝不易发生化学反应
B.铝的氧化物易发生还原反应
C.铝不易被氧化
D.铝易被氧化为氧化铝,氧化铝膜具有保护内部铝的作用
 天天练口算系列答案
天天练口算系列答案科目:高中化学 来源:2016届甘肃省高三上学期第四次月考理综化学试卷(解析版) 题型:选择题
下列实验操作能达到目的的是
A.用铂丝蘸取少量某溶液进行焰色反应,火焰呈黄色,该溶液一定是钠盐溶液
B.制取二氧化氮时,用水或NaOH溶液吸收尾气
C.为测定Na2CO3和NaHCO3混合物中Na2CO3质量分数,取a g混合物与足量稀硫酸充分反应,逸出气体用碱石灰吸收,增重b g,该方案可行。
D.为测定镀锌铁皮的锌层厚度,将镀锌铁皮与足量盐酸反应待气泡明显减少时取出,
洗涤,烘干,称重。若烘干时间过长,会导致测定结果偏小。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年甘肃省高一上期末考试化学试卷(解析版) 题型:选择题
下列反应的离子方程式中,书写正确的是 ( )
A.钠跟水反应:Na + 2H2O = Na+ + 2OH- + H2↑
B.向硫酸溶液中加入Ba(OH)2溶液: H++SO42-+Ba2++OH- =H2O+BaSO4↓
C.向A12(SO4)3溶液中加入过量的氨水:A13++3NH3·H2O=A1(OH)3↓+3NH4+
D.FeCl2溶液跟Cl2反应:Fe2++Cl2 == Fe3++2Cl-
查看答案和解析>>
科目:高中化学 来源:2015-2016学年黑龙江省高一上期末化学试卷(解析版) 题型:实验题
制得的碳酸钠样品中往往含有少量NaCl,现欲测定样品中Na2CO3的质量分数,某探究性学习小组分别设计了如下实验方案。请回答下列有关问题:
方案一:把一定质量的样品溶解后加入过量的CaCl2溶液,将所得沉淀 (填操作名称)、洗涤、烘干、称量、计算。洗涤沉淀的具体操作是 。
方案二:把一定量的样品与足量硫酸反应后,用下图所示装置测定产生CO2的体积,为了确保测定结果的准确性,B中的溶液最好采用 。下图装置中实验仪器a的名称是 。
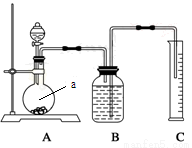
方案三:利用下图所示装置来测定纯碱样品中碳酸钠的质量分数(铁架台、铁夹等在图中均已略去)。实验步骤如下:
①按图连接装置,并检查气密性;
②准确称得盛有碱石灰的干燥管D的质量为33.4g;
③准确称得6g纯碱样品放入容器b中;
④打开分液漏斗a的旋塞,缓缓滴入稀硫酸,至不再产生气泡为止;
⑤打开弹簧夹,往试管A中缓缓鼓入空气数分钟,然后称得干燥管D的总质量为35.6g。
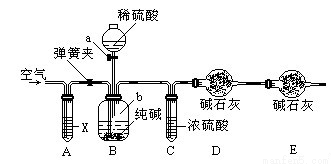
(1)若④⑤两步的实验操作太快,则会导致测定结果 (填“偏大”或“偏小”)。
(2)装置A中试剂X应选用 。
(3)E装置的作用是 。
(4)根据实验中测得的有关数据,计算纯碱样品Na2CO3的质量分数为 (结果保留小数点后一位)。
查看答案和解析>>
科目:高中化学 来源:2015-2016年陕西西藏民族学院附属中学高一上期末化学卷(解析版) 题型:选择题
印刷铜制电路板的“腐蚀液”为FeCl3溶液已知铜、铁均能与FeCl3溶液反应,反应方程式分别为:Cu+2FeCl3=2FeCl2+CuCl2,Fe+2FeCl3=3FeCl2。现将一包铜、铁的混合粉末加入到盛有FeCl3溶液的烧杯中,充分反应后烧杯中仍有少量固体。关于烧杯中物质组成的说法正确的是
A.溶液中一定含FeCl3,固体一定是铁和铜
B.溶液中一定含FeCl2,固体一定含铜
C.溶液中一定含FeCl2、CuCl2,固体一定含铜
D.溶液中一定含FeCl2,固体一定是铁和铜
查看答案和解析>>
科目:高中化学 来源:2015-2016学年黑龙江省高二上期末化学试卷(解析版) 题型:选择题
在恒温恒容密闭容器中,将CO和H2S混合并达到下列平衡:CO (g) +H2S (g)  COS (g) +H2 (g),平衡常数K=1,反应前CO的物质的量为l0mol,平衡后CO物质的量为8mol。下列说法正确的是( )
COS (g) +H2 (g),平衡常数K=1,反应前CO的物质的量为l0mol,平衡后CO物质的量为8mol。下列说法正确的是( )
A.若容器内压强不再变化,则说明该反应己达平衡
B.反应前H2S物质的量为2.5mol
C.CO和H2S达平衡后的转化率相同
D.若平衡后再加入CO,则正反应速率增大,逆反应速率减小
查看答案和解析>>
科目:高中化学 来源:2015-2016学年黑龙江省高二上期末化学卷(解析版) 题型:选择题
电渗析法是一种利用离子交换膜进行海水淡化的方法,其原理如图所示。已知海水中含Na+、Cl-、Ca2+、Mg2+、SO42-等离子,电极为惰性电极。下列叙述中正确的是( )
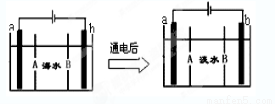
A.A膜是阳离子交换膜
B.通电后,海水中阴离子往b电极处运动
C.通电后,a电极的电极反应式为 4OH--4e-=O2↑ +2H2O
D.通电后,b电极上产生无色气体,溶液中出现少量白色沉淀
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山西省孝义市高一下学期升级考试化学试卷(解析版) 题型:实验题
实验室合成乙酸乙酯的步骤如下:在圆底烧瓶内加入乙醇、浓硫酸和乙酸,瓶口竖直安装通有冷却水的冷凝管(使反应混合物的蒸气冷凝为液体流回烧瓶内),加热回流一段时间后换成蒸馏装置进行蒸馏,得到含有乙醇、乙酸和水的乙酸乙酯粗产品。请回答下列问题:(已知:乙醇、乙酸、乙酸乙酯的沸点依次是78.4℃、118℃、77.1℃)
(1)在烧瓶中除了加入乙醇、浓硫酸和乙酸外,还应放入几块碎瓷片,其目的是_____________。
(2)在烧瓶中配制一定比例的乙醇和浓硫酸的混合液的方法是:__________________。
(3)在该实验中,若用1 mol乙醇和1 mol乙酸在浓硫酸作用下加热,充分反应,能否生成1mol乙酸乙酯?______________,原因是____________________。
(4)现拟分离含乙酸、乙醇和水的乙酸乙酯粗产品,下图是分离操作步骤流程图。请在图中圆括号内填入适当的试剂,在方括号内填入适当的分离方法。
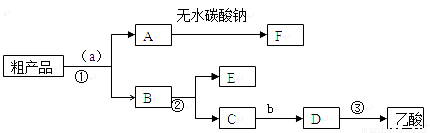
试剂a是__________,试剂b是__________;分离方法①是__________,分离方法②是__________,分离方法③是____________。
(5)在得到的A中加入无水碳酸钠粉末,振荡,目的是_________________。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山东省济宁任城区高二上学期统考化学试卷(解析版) 题型:选择题
已知热化学方程式:2A(g)+B(g) 2C(g) ΔH=-QkJ·mol-1(Q﹥0)。下列说法正确的是
2C(g) ΔH=-QkJ·mol-1(Q﹥0)。下列说法正确的是
A.相同条件下,2molA(g)和1molB(g)所具有的总能量小于2mol C(g)所具有的能量
B.增大压强或升高温度,该平衡都向逆反应方向移动
C.将2molA(g)和1molB(g)置于一密闭容器中充分反应后,放出热量为QkJ
D.如将一定量A(g)和B(g)置于某密闭容器中充分反应放热Q kJ,则此过程中有2molA(g)被消耗
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com