
已知离子反应:Fe3++3SCN-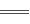 Fe(SCN)3具有反应迅速、现象明显等特点,是检验Fe3+常用的方法之一。某化学兴趣小组为探究Fe(SCN)3的性质,做了以下实验:
Fe(SCN)3具有反应迅速、现象明显等特点,是检验Fe3+常用的方法之一。某化学兴趣小组为探究Fe(SCN)3的性质,做了以下实验:
①取10 mL l mol·L-1FeCl3溶液,滴加3~4滴浓KSCN溶液,振荡后溶液立即变成红色。
②取少量红色溶液,滴加少许浓硝酸,静置,溶液红色褪去,同时产生大量的红棕色气体混合物A。
③将该气体混合物A通入过量的Ba(OH)2溶液中,产生白色沉淀B和剩余气体C。
气体C无色无味,能使燃烧的木条熄灭,可排放到空气中,不会改变空气的成分。
④过滤,向白色沉淀B中滴加少量稀硝酸,沉淀完全溶解,同时产生能使澄清石灰水变浑浊的无色无味气体D。
⑤取②中反应后溶液少许,滴加BaCl2溶液,产生不溶于稀硝酸的白色沉淀E。
根据上述实验现象,回答下列问题:
(1)B的化学式为_________________;E的化学式为___________________。
(2)混合气体A的成分是___________________(填化学式)。
(3)该兴趣小组同学根据以上实验现象分析得出结论:Fe(SCN)3具有还原性,则实验②中反应时被氧化的元素是____________(填元素符号)。根据元素C、S、N的原子结构和共价键的相关知识推断出SCN-的结构式为_________________。
(4)实验②中反应的离子方程式为___________________________________________。
(5)该兴趣小组同学从上述实验中得到启发,若用SCN-间接检验Fe2+时应注意
_________________________________________________________________。
【知识点】物质性质的探究、氧化还原反应方程式的书写B3 J4
【答案解析】(1)BaCO3 BaSO4(各1分)
(2)NO2、CO2、N2 (2分) (3)S、N(2分) [S—C≡N]-(2分)
(4)2SCN-+22NO3-+20H+=2SO42-+2CO2↑+22NO2↑+N2+10H2O(2分)
(5)加入氧化剂不能过量(2分)
解析:取少量红色溶液,滴加少许浓硝酸,静置,溶液红色褪去,同时产生大量的红棕色气体混合物A,A中含NO2,将该气体混合物A通入过量的Ba(OH)2溶液中,产生白色沉淀B和剩余气体C,气体C无色无味,能使燃烧的木条熄灭,可排放到空气中,不会改变空气的成分,则C是N2,过滤,向白色沉淀B中滴加少量稀硝酸,沉淀完全溶解,同时产生能使澄清石灰水变浑浊的无色无味气体D,则D是CO2,白色沉淀B是BaCO3。取②中反应后溶液少许,滴加BaCl2溶液,产生不溶于稀硝酸的白色沉淀E,则E是BaSO4,所以
(1)B的化学式为BaCO3;E的化学式为BaSO4。
(2)混合气体A的成分是NO2、CO2、N2。
(3)该兴趣小组同学根据以上实验现象分析得出结论:Fe(SCN)3具有还原性,S的化合价从-2升高到+6,N的化合价从-3升高到0,则实验②中反应时被氧化的元素是S、N。根据元素C、S、N的原子结构和共价键的相关知识推断出SCN-的结构式为 [S—C≡N]-。
(4)实验②中KSCN被氧化,得到SO42-、N2,NO3-还原为N2、反应的离子方程式为2SCN-+22NO3-+20H+=2SO42-+2CO2↑+22NO2↑+N2+10H2O。
(5)从上述实验中可知KSCN能够被强氧化性的物质氧化,所以得到的启发是用SCN-间接检验Fe2+时应注意加入氧化剂不能过量。
【思路点拨】本题考查物质性质的探究、氧化还原反应方程式的书写,看懂实验步骤是关键。


 53随堂测系列答案
53随堂测系列答案科目:高中化学 来源: 题型:
某芳香族化合物A,苯环上的一氯代物有两种,A完全燃烧只生成二氧化碳和水,一定条件下存在如图所示的转化关系(方框中Mr代表相对分子质量):
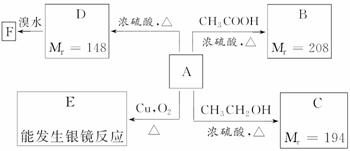
请回答下列问题:
(1)A的摩尔质量为________,在一定条件下B可能发生的化学反应的反应类型有________(填序号)。
①水解反应 ②取代反应 ③加成反应 ④消去反应
⑤加聚反应
(2)C的结构简式为____________________________________________________。
E的结构简式为_______________________________________________________。
(3)写出下列转化的化学方程式:
①A――→B: ____________________________________________________。
②D――→F: ____________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
若(NH4)2SO4在强热时分解的产物是SO2、N2、NH3和H2O,则该反应中化合价发生变化和未发生变化的N原子数之比为
A.1:4 B. 1:2 C. 2:1 D.4:1
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关Fe2(SO4)3溶液的叙述正确的是
A.该溶液中K+、Fe2+、SCN-、Br-可以大量存在
B.和KI溶液反应的离子方程式: Fe3++2I- =Fe2++I2
C.和Ba(OH)2溶液反应离子方程式:Fe3++ SO42-+Ba2++3OH-=Fe(OH)3↓+BaSO4↓
D. 1 L0.1 mol·L-1该溶液和足量的Zn充分反应,生成11.2g Fe
查看答案和解析>>
科目:高中化学 来源: 题型:
三氟化氮(NF3)是一种新型电子材料,它在潮湿的空气中与水蒸气能发生氧化还原反应,其反应的产物有:HF、NO和HNO3。下列有关说法正确的是
A.反应中NF3是氧化剂,H2O是还原剂
B.反应中被氧化与被还原的原子物质的量之比为2:1
C.若反应中生成0.2 mol HNO3,则反应共转移0.2 mol e-
D. NF3在潮湿空气中泄漏会产生白雾、红棕色气体等现象
查看答案和解析>>
科目:高中化学 来源: 题型:
在下列各溶液中,离子一定能大量共存的是: ( )
A.pH=11的溶液中:CO32-、Na+、AlO2-、NO3-
B.含有0.1mol·L-1Fe3+的溶液中:K+、Mg2+、I-、NO3-
C.无色溶液中:K+、Na+、MnO4-、SO42-
D.室温下,pH=1的溶液中:Na+、Fe2+、NO3-、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
碱式碳酸盐A可用作胃药,其组成可表示为Al2Mg6(OH)x(CO3)y·zH2O。某校化学兴趣小组欲测定其化学式,实验设计如下:
实验Ⅰ:称取一定质量的A,加热分解至恒重。
实验Ⅱ:称取一定质量的A,与足量的酸反应,测量生成CO2气体的质量。
可供选择的仪器和药品如图所示:(酸溶液限选6 mol·L-1盐酸或6 mol·L-1硫酸,其他试剂任选)
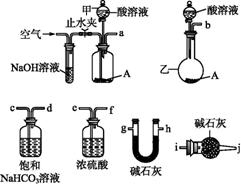
回答下列问题:
(1)仪器乙的名称为 。
(2)请选择必要的装置完成实验Ⅱ,正确的连接顺序为 (按气流方向,用接口字母表示);选用的酸溶液是 。
(3)有人提出不采用实验Ⅰ,可在实验Ⅱ结束后,在A完全反应后所得溶液中滴加足量的氨水,用无灰滤纸过滤,用蒸馏水洗涤反应容器2~3次,将洗涤液过滤,洗涤沉淀2~3次,将附着沉淀的滤纸放到坩埚中加热分解至恒重。判断沉淀已洗涤干净的方法是 ,实际上 未采用该方案的原因是不符合实验设计的 (填字母编号)原则。
未采用该方案的原因是不符合实验设计的 (填字母编号)原则。
A.科 学性 B.安全性
学性 B.安全性
C.可行性 D.简约性
(4)x与y的关系式是 (用等式表示)。
(5)通过实验Ⅰ的相关数据,经计算可得A的摩尔质量为602.0 g·mol-1。实验Ⅱ中称得样品A的质量为9.030 g,与足量酸完全反应后,CO2吸收装置增重0.660 g,则A的化学式为  。
。 
查看答案和解析>>
科目:高中化学 来源: 题型:
萘环上的碳原子的编号如(Ⅰ)式,根据系统命名法,(Ⅱ)式可称为2硝基萘,则化合物(Ⅲ)的名称应是( )
 A.2,6二甲基萘 B.1,4二甲基萘
A.2,6二甲基萘 B.1,4二甲基萘
C.4,7二甲基萘 D.1,6二甲基萘
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com