
常温下,物质的量浓度为0.01 mol·L-1的醋酸溶液和盐酸,下列说法正确的是
A.溶液的pH相同
B.分别加入足量锌片,盐酸生成的H2体积大
C.分别稀释100倍后,醋酸浓度与盐酸浓度相等
D.由水电离出的氢离子浓度均为1×10-12 mol·L-1
科目:高中化学 来源:2014高考名师推荐化学三类分散系及比较(解析版) 题型:选择题
甲、乙两物质的溶解度曲线如图所示。下列叙述中正确的是
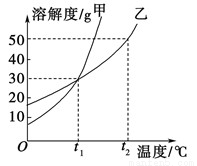
A.t1 ℃时,在100 g水中放入60 g甲,其溶质的质量分数为37.5%
B. t1 ℃时,甲和乙的饱和溶液的物质的量浓度一定相等
C.t2 ℃时,甲和乙的饱和溶液中溶质的质量分数一定相等
D.t2 ℃时,分别在100 g水中各溶解20 g甲、乙,同时降低温度,甲先达到饱和
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学Ksp概念及简单应用(解析版) 题型:选择题
下列说法正确的是
A.KClO3和SO3溶于水后能导电,故KClO3和SO3为电解质
B.25℃时、用醋酸溶液滴定等浓度NaOH溶液至pH=7,V醋酸<VNaOH
C.向NaAlO2溶液中滴加NaHCO3溶液,有沉淀和气体生成
D.AgCl易转化为AgI沉淀且K(AgX)=c(Ag+)? c(X—),故K(AgI)<K(AgCl)
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测8 题型:实验题
某兴趣小组为探究氮的化合物的性质,设计了如图所示实验装置,A为气体发生装置。

按上图连接好各仪器,检查装置气密性后,先将C处铂丝网加热至红热,再将A处产生的无色气体通过后面装置。片刻后可观察到F中铜片慢慢溶解。请回答下列问题:
(1)A制备气A中所用试剂,从下列固体物质中选取:①NH4HCO3、②NH4Cl、③Ca(OH)2)相对应的装置可以是________(填字母)。

(2)写出题干装置C中发生反应的化学方程式________,C处加热片刻后撤去酒精灯,铂丝仍保持红热,原因是________________________________________。
(3)铜片完全溶解后,发现F装置中溶液呈绿色,加水稀释后呈蓝色,有同学得出两种结论:①浓Cu(NO3)2溶液呈绿色,稀Cu(NO3)2溶液呈蓝色;②Cu(NO3)2溶液呈蓝色,呈绿色是由于溶液溶解过量的NO2,试设计实验验证哪一种结论正确______________________________________________________________。
 (4)该兴趣小组同学共同设计了如图所示的实验装置,利用装置Ⅰ、Ⅱ制取气体,请回答下列问题:
(4)该兴趣小组同学共同设计了如图所示的实验装置,利用装置Ⅰ、Ⅱ制取气体,请回答下列问题:
①甲同学认为:利用装置Ⅱ可以收集H2、NH3等气体,但不能收集O2和NO,理由是______________________________________________。
②乙同学认为:利用装置Ⅱ作简易改进(不改变仪器装置),可收集NO、O2,改进的方法是__________________________________________。
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测8 题型:选择题
据下图判断,下列说法不正确的是

A、(C6H10O5)n可表示淀粉或纤维素
B、反应②化学方程式为C6H12O62C2H5OH+2CO2↑
C、反应③得到的乙酸乙酯中含有乙醇和乙酸,可用饱和氢氧化钠溶液除去
D、反应③和④都属于取代反应
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测8 题型:选择题
下列叙述中正确的是
A.K3C60在熔融状态下能够导电,所以K3C60是电解质
B.胶体和溶液的本质区别在于能否发生丁达尔现象
C.离子键的本质就是阴阳离子之间的相互吸引
D.变化过程中化学键被破坏,则一定发生化学变化
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测7 题型:实验题
黄铜矿是工业炼铜的主要原料,其主要成分为CuFeS2,现有一种天然黄铜矿(含少量SiO2),为了测定该黄铜矿的纯度,某同学设计了如下实验:

现称取研细的黄铜矿样品1.150g,在空气存在下进行煅烧,生成Cu、Fe3O4和SO2气体,实验后取d中溶液的1/10置于锥形瓶中,用0.05mol/L标准碘溶液进行滴定,消耗标准溶液20.00mL。请回答下列问题:
(1)称量样品所用的仪器为 (填“托盘天平”或“电子天平”),将样品研细后再反应,其目的是 。
(2)装置a和c的作用分别是 和 (填标号)。
a.除去SO2气体
b.除去空气中的水蒸气
c.有利于气体混合
d.有利于观察空气流速
e.除去反应后多余的氧气
(3)上述反应结束后,仍需通一段时间的空气,其目的是 。
(4)通过计算可知,该黄铜矿的纯度为 。
(5)若用右图装置替代上述实验装置d,同样可以达到实验目的的是 (填序号)。

(6)若将原装置d中的试液改为Ba(OH)2,测得的黄铜矿纯度误差为+1%,假设实验操作均正确,可能的原因主要有 。
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测6 题型:简答题
某已知A、B均是由两种短周期元素组成的化合物,A中某元素的质量分数为25%,B的焰色反应呈黄色,C、J、X是同周期的元素的简单氢化物,X为无色液体,C、J为气体,D是一种不溶于水的白色固体。反应生成的水均已略去。它们有如下图所示的关系。

(1)写出化学式:A_________ E___________ L___________;
(2)在反应①②③④⑤中属于氧化还原反应的是_____________;
(3)反应③化学方程式为:______________________________;
(4)写出下列离子方程式:反应② ;G溶液与M溶液的反应___________。
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测4 题型:简答题
已知A、B、C、D、E都是元素周期表中的前四周期元素,它们原子序数的大小关系为A<C<B<D<E。又知A原子的p轨道为半充满,其形成的简单氢化物的沸点是同主族非金属元素的氢化物中最高的。D原子得到一个电子后其3p轨道将全充满。B+离子比D原子形成的离子少一个电子层。C与B可形成BC型的离子化合物。E的原子序数为29。
请回答下列问题:
(1) 元素A简单氢化物中A原子的杂化类型是________,B、C、D的电负性由小到大的顺序为______(用所对应的元素符号表示)。C的气态氢化物易溶于水的原因是____________________。
(2)E原子的基态电子排布式为________。元素E的单质晶体在不同温度下可有两种堆积方式,晶胞分别如图a和b所示,则其面心立方堆积的晶胞与体心立方堆积的晶胞中实际含有的E原子的个数之比为____________。

(3)实验证明:KCl、MgO、CaO、TiN这4种晶体的结构与NaCl晶体结构相似(如图所示),其中3种离子晶体的晶格能数据如下表:
离子晶体 | NaCl | KCl | CaO |
晶格能/kJ·mol-1 | 786 | 715 | 3401 |
则该4种离子晶体(不包括NaCl)熔点从高到低的顺序是:________。
(4)金属阳离子含未成对电子越多,则磁性越大,磁记录性能越好。离子型氧化物V2O5和CrO2中,适合作录音带磁粉原料的是________。
(5)温室效应,科学家设计反应:CO2+4H2—→CH4+2H2O以减小空气中CO2。若有1 mol CH4生成,则有________mol σ键和________mol π键断裂。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com