
| A.pH=7的醋酸钠和醋酸混合液中:c(Na+)=c(CH3COO-) |
| B.0.1mol/L的醋酸的pH=a,0.01mol/L的醋酸的pH=b,则a+1>b |
| C.0.1mol/L的醋酸钠溶液20mL与0.1mol/L盐酸10mL混合后溶液显酸性 c (CH3COO-)>c (Cl-)>c (H+)>c (CH3COOH) |
| D.已知酸性HF>CH3COOH,pH相等的NaF与CH3COOK溶液中, |
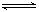 CH3COOH+ OH-
CH3COOH+ OH-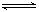 CH3COO-+ H+,NaCl: NaCl= Na++ Cl-
CH3COO-+ H+,NaCl: NaCl= Na++ Cl-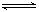 HF+ OH-,
HF+ OH-,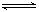 CH3COOH+ OH-,
CH3COOH+ OH-,

科目:高中化学 来源:不详 题型:实验题
| 实验序号 | 待测液体积(mL) | 所消耗盐酸标准液的体积(mL) | |
| 滴定前 | 滴定后 | ||
| 1 | 20.00 | 0.50 | 20.70 |
| 2 | 20.00 | 6.00 | 26.00 |
| 3 | 20.00 | 1.40 | 21.20 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.溶液的pH相同时,3种溶液物质的量浓度大小顺序是③>②>① |
| B.溶液的pH相同时,将3种溶液稀释相同倍数,pH变化最大的是① |
C.溶液的pH相同时,由水电离出的 大小顺序是③>②>① 大小顺序是③>②>① |
| D.若3种溶液的物质的量浓度都相同,则溶液的pH大小顺序是①>②>③ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.1 : 1 | B.2 : 1 | C.1 : 10 | D.10 : 1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| ①硫酸溶液 | ②硫酸氢钠溶液 | ③醋酸溶液 | ④盐酸 |
HSO4-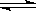 H++SO42— H++SO42— | HSO4-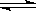 H++SO42- H++SO42- | CH3COOH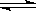 CH3COO-+H+ CH3COO-+H+ | HCl = H++Cl- |
| 10℅ | 29℅ | 1.33℅ | 100℅ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.H2(g)+Cl2(g)=2HCl(g); △H="-183" kJ·mol-1 |
| B.H2(g)+Cl2(g)=2HCl(g); △H=+183kJ·mol-1 |
| C.H2(g)+Cl2(g)=2HCl(g);△H=-91.5kJ·mol-1 |
| D.H2(g)+Cl2(g)=2HCl(g);△H=+91.5kJ·mol-1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| A.c(Na+)+ c(H+)= c(OH—)+ c(HCO3—)+ 2c(CO32—) |
B.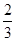 c(Na+)= c(HCO3—)+ c(CO32—)+ c(H2CO3) c(Na+)= c(HCO3—)+ c(CO32—)+ c(H2CO3) |
| C.c(Na+)> c(CO32—)> c(HCO3—)> c(OH—)> c(H+) |
| D.c(Na+)> c(HCO3—)> c(CO32—)> c(OH—)> c(H+) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.②③⑤ | B.①④⑥ | C.①②④⑥ | D.①②③④⑤⑥ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com