
| A. | 难挥发 | B. | 不能与水互溶 | C. | 能燃烧 | D. | 不能和乙酸反应 |
 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

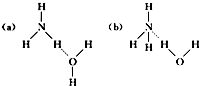
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
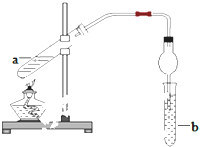 如图,在试管a中先加入2mL95%的乙醇,再加入3mL无水醋酸,边摇边缓缓加入2mL浓H2SO4,用玻璃棒充分搅拌后将试管固定在铁架台上,在试管b中加入5mL饱和碳酸钠溶液.连接好装置.用酒精灯对试管a加热,当观察到试管b中有明显现象时停止实验.
如图,在试管a中先加入2mL95%的乙醇,再加入3mL无水醋酸,边摇边缓缓加入2mL浓H2SO4,用玻璃棒充分搅拌后将试管固定在铁架台上,在试管b中加入5mL饱和碳酸钠溶液.连接好装置.用酒精灯对试管a加热,当观察到试管b中有明显现象时停止实验. CH3COOC2H5+H2O.
CH3COOC2H5+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,离子键,共价键;
,离子键,共价键;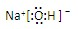 ,离子键,共价键;
,离子键,共价键; ;共价键;
;共价键; ,共价键,离子键.
,共价键,离子键.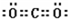 ;共价键;
;共价键; ;共价键.
;共价键.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验步骤 | 向3-4mL 1mol/L AgNO3溶液中滴入1mol/L的Na2SO4溶液至反应完全. |
| 实验现象 | ①产生白色沉淀 |
| 离子方程式 | 2Ag++SO${\;}_{4}^{2-}$=Ag2SO4 |
| 小组讨论交流 | 取上述反应后的清液于试管中滴入适量1mol/L的NaCl 溶液,对于会出现的现象提出了假设 |
| 提出假设 | 假设Ⅰ:反应没有限度 假设Ⅱ:②无现象 |
| 证明假设Ⅱ | 现象③:产生白色沉淀;理由④反应存在限度,溶液中尚有较多Ag+ |
| 离子方程式 | ⑤Ag++Cl-=AgCl↓ |
| 解释 | ⑥加入Cl-产生了大量的白色沉淀,说明Ag++Cl- AgCl↓反应是可逆反应,存在反应限度,所以Ag+不能反应完,才出现这种现象 AgCl↓反应是可逆反应,存在反应限度,所以Ag+不能反应完,才出现这种现象 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 氢氧化物 | Cu(OH)2 | Fe(OH)3 | Fe(OH)2 | Mg(OH)2 |
| Ksp | 2.2×10-20 | 4.0×10-38 | 8.0×10-16 | 1.8×10-11 |
| 温度(K) | 平衡时NH3的物质的量(mol) |
| T1 | 2.4 |
| T2 | 2.0 |
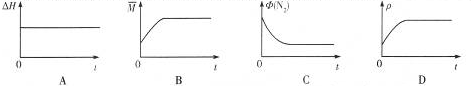
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 异戊二烯(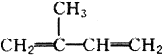 )与等物质的量的Br2发生加成反应 )与等物质的量的Br2发生加成反应 | |
| B. | 2-氯丁烷(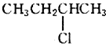 )与NaOH乙醇溶液共热发生消去HCl分子的反应 )与NaOH乙醇溶液共热发生消去HCl分子的反应 | |
| C. | 甲苯在一定条件下发生硝化反应生成一硝基甲苯的反应 | |
| D. | 新戊烷和氯气发生取代反应生成一氯取代物的反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com