
| A. | 反应I2(g)+H2(g)?2H I(g) 达平衡后,压缩体积体系颜色变深 | |
| B. | H2O2中加入二氧化锰,生成氧气的速率加快 | |
| C. | 棕黄色的FeCl3溶液中加入铁粉颜色逐渐变为浅绿色 | |
| D. | 反应CO(g)+NO2(g)?CO2(g)+NO(g)△H<0,达平衡后,升高温度体系颜色变深 |
分析 勒夏特列原理主要内容为:在一个已经达到平衡的反应中,如果改变影响平衡的条件之一(如温度、压强,以及参加反应的化学物质的浓度),平衡将向着能够减弱这种改变的方向移动,能用勒夏特列原理解释,首先必须存在可逆过程,以此解答该题.
解答 解:A、对于反应2HI(g)?H2(g)+I2(g),增大平衡体系的压强平衡不移动,不能用化学平衡移动原理解释,故A不符合;
B、加入催化剂有利于合成氨的反应,催化剂使用平衡不移动,不能用化学平衡移动原理解释,故B不符合;
C、棕黄色的FeCl3溶液中加入铁粉会发生反应生成氯化亚铁溶液,是一种浅绿色的溶液,和化学平衡移动原理无关,故C不符合;
D、反应CO(g)+NO2(g)?CO2(g)+NO(g)(正反应为放热反应),达平衡后,升高温度平衡逆向移动,体系颜色变深,故D符合.
故选D.
点评 本题考查了勒夏特列原理的使用条件,注意使用勒夏特列原理的前提必须是可逆反应,题目难度不大.


 双基同步导航训练系列答案
双基同步导航训练系列答案 黄冈小状元同步计算天天练系列答案
黄冈小状元同步计算天天练系列答案科目:高中化学 来源: 题型:选择题
| A. | 阴离子数和阳离子数 | |
| B. | 阳离子的正电荷总数和阴离子的负电荷总数 | |
| C. | 阴、阳离子的质量 | |
| D. | 每个阳离子与每个阴离子所带的电荷 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸、碱、盐都是电解质 | |
| B. | 蔗糖、酒精是非电解质 | |
| C. | 盐酸是强电解质 | |
| D. | NH3的水溶液能导电,但NH3不是电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 110 kJ | B. | 440 kJ | C. | 1100 kJ | D. | 2216 kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
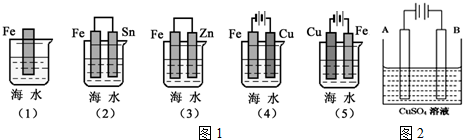
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2:1 | B. | 1:1 | C. | 2:3 | D. | 1:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 表示碳原子,用
表示碳原子,用  表示氧原子,用
表示氧原子,用  表示氮原子,如图为气体转换的微观过程.请你根据图示回答下列问题:
表示氮原子,如图为气体转换的微观过程.请你根据图示回答下列问题: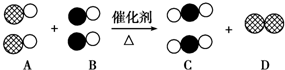
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 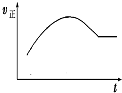 绝热恒容密闭容器中通入A和B,发生反应:2A (g)+B (g)?2C(g),如图为其正反应速率随时间变化的示意图,则该反应为放热反应 | |
| B. | 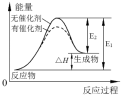 催化剂能降低反应的活化能,提高活化分子的百分含量,从而加快化学反应速率.如图显示的是催化反应与无催化反应过程中的能量关系 | |
| C. |  将BaO2放入密闭真空容器中,反应2BaO2(s)?2BaO(s)+O2(g)达到平衡时体系压强为P,保持温度不变,t0时刻将容器体积缩小为原来的$\frac{1}{2}$,体系重新达到平衡,体系压强变化如图所示 | |
| D. | 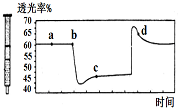 将一定量的NO2充入针筒中后封口,发生反应2NO2 (g)?N2O4(g),如图表示在拉伸和压缩针筒活塞的过程中气体透光率随时间的变化(气体颜色越深,透光率越小).则c点与a点相比,c(NO2)增大,c(N2O4)减小. |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com