
【题目】某化工厂制备净水剂硫酸铁铵晶体[NH4Fe(SO4)2·6H2O]的一种方案如下:
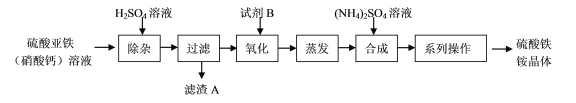
下列说法不正确的是
A. 滤渣A的主要成分是CaSO4
B. 相同条件下,NH4Fe(SO4)2·6H2O净水能力比FeCl3强
C. “合成”反应要控制温,温度过高,产率会降低
D. “系列操作”包括蒸发浓缩、降温结晶、过滤、干燥等
科目:高中化学 来源: 题型:
【题目】铝是应用广泛的金属。以铝土矿(主要成分为Al2O3,含SiO2和Fe2O3等杂质)为原料制备铝的一种工艺流程如下:
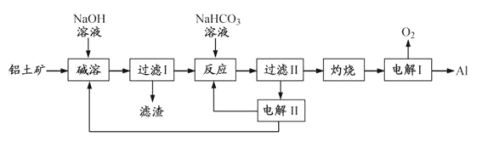
注:SiO2在“碱溶”时转化为铝硅酸钠沉淀。
(1)“碱溶”时生成偏铝酸钠的离子方程式为___。
(2)向“过滤Ⅰ”所得滤液中加入NaHCO3溶液,溶液的pH___(填“增大”、“不变”或“减小”)。
(3)“电解Ⅰ”是电解熔融Al2O3,电解过程中作阳极的石墨易消耗,原因是___。冰晶石的作用是___。
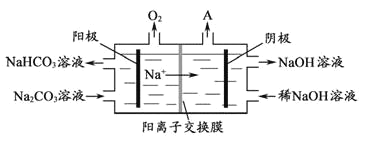
(4)“电解Ⅱ”是电解Na2CO3溶液,原理如图所示。阴极产生的物质A的化学式为___;电解时,若阴极生成标况下44.8L的A,则阳极产生NaHCO3的质量为___g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组按下列路线合成非甾体抗炎、抗过敏药物乙氧苯柳胺,工业上可通过分馏煤焦油获得A。
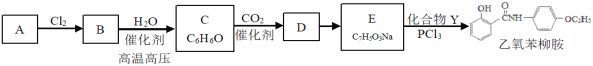
已知:R-Cl+R'-OH![]() R-O-R'+HCl;
R-O-R'+HCl;
![]()
![]()
![]()
请回答:NH2
(1)反应B→C的类型是__________,化合物D中含氧官能团的名称______。
(2)下列说法正确的是_________。
A 化合物C加入过量溴的四氯化碳溶液中,能产生白色沉淀
B 化合物D能发生加成、取代、氧化反应、缩聚反应
C 实现D→E的转化应加入过量Na2CO3溶液
D 乙氧苯柳胺的分子式是C15H15NO3
(3)化合物E的结构简式是__________。
(4)化合物D能与许多物质反应,如:化合物D与足量NaOH溶液反应生成有机物X,请写出少量CO2通入X溶液中发生反应的化学方程式__________。
(5)写出化合物Y(C8H11NO)同时符合下列条件的所有同分异构体的结构简式_______。
1H-NMR谱和1R谱检测表明:
①分子中有4种不同化学环境的氢原子。
②分于中含有苯环,没有羟基。
(6)结合题目信息,设计以B和CH3CH2OH为原料制备化合物Y的合成路线(用流程图表示,无机试剂任选)__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨及其相关工业中,部分物质间的转化关系如下:
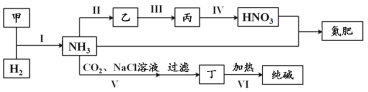
下列说法不正确的是
A.甲、乙、丙三种物质中都含有氮元素
B.反应II、III和Ⅳ的氧化剂相同
C.VI的产物可在上述流程中被再次利用
D.V中发生反应:NH3+CO2+H2O+NaCl===NaHCO3↓+NH4Cl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中学常见物质 A、B、C、D、E、X,存在下图转化关系 (部分生成物和反应条件略去)。 下列推断不正确的是 ( )

A. 若D为NaCl,且A可与C反应生成B,则 E 可能是 CO2
B. 若D是一种强碱, 则A、B、C 均可与 X 反应生成 D
C. 若D是一种白色沉淀, 在空气中最终变为红褐色,则 A可能是铁
D. 若D是一种强酸,则A既可以是单质,也可以是化合物,且D可与铜反应生成B或C
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F六种物质有如下转化关系,E为淡黄色粉末,通常用在呼吸面具中作为氧气的来源。

(1)A、C、E、F的化学式:
A______,C______,E______,F______。
(2)向饱和的C的溶液中通入足量CO2,会出现的现象是_____,有关反应的化学方程式为____。
(3)鉴别C与F溶液应选用的试剂是_____,有关反应的离子方程式为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氯化铁溶液可腐蚀印刷电路板.上的铜膜,某教师为了从腐蚀废液(含有大量FeCl3、FeCl2、CuCl2)中回收铜,并将铁的化合物全部转化为FeCl3溶液作为腐蚀液原料循环使用。准备采用下列步骤:
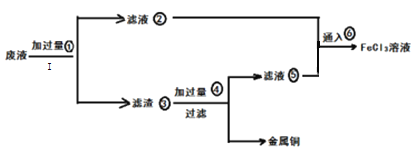
(1)步骤I的操作名称:_________________ :所需玻璃仪器:_______________________
(2)写出FeCl3溶液与铜箔发生反应的离子方程式:__________________________________
(3)检验废腐蚀液中是否含有Fe3+所需试剂:______________________(填名称)
(4)向②中加入NaOH溶液并长时间暴露在空气中,此过程的现象:_______________________此转化的化学方程式为:___________________________________________________________
(5)写出③中所含物质:__________________(填化学式)⑥发生反应的离子方程式:________
(6)若向盛有氯化铁溶液的烧杯中同时加入铁粉和铜粉。反应结束后,下列结果不可能出现的是_____(填写编号)
A.有铜无铁 B.有铁无铜 C.铁、铜都有 D.铁、铜都无
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.写出下列典型物质的电离方程式
(1)H2SO4_________________________________________
(2)Fe(OH)3________________________________________
(3)NaHSO4_________________________________________
(4)NaHCO3________________________________________
(5)Al2O3(熔融)____________________________________
II.写出下列典型反应的离子方程式:
(1)在稀H2SO4中加入CH3COONa溶液___________________________________
(2)氧化镁溶于稀硫酸______________________________________________
(3)CuSO4溶液与Ba(OH)2溶液混合_______________________________________
(4)NaHCO3溶液与稀盐酸混合________________________________________
(5)NaHSO4溶液与NaOH溶液混合_____________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是中学化学中常见物质之间的一些反应关系,其中部分产物未写出。常温下X是固体,B和G是液体,其余均为气体。根据如图关系推断:
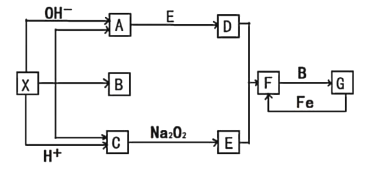
(1)写出化学式:A____,G____。
(2)实验室收集气体D和A的方法依次是____法、_____法。
(3)写出C→E的化学方程式:____。
(4)请写出A与E反应生成D的化学方程式:_____。
(5)检验物质A的方法和现象是______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com