
分析 ①氯气具有强氧化性,向盛有KI溶液的试管中加入少许CCl4后滴加氯水,CCl4层变成紫色,说明生成I2,继续向试管中滴加氯水,振荡,CCl4层会逐渐变浅,最后变成无色,说明I2被进一步氧化,生成HIO3,同时氯气被还原为HCl,则碘元素化合价变化为:0→+5,氯气中氯元素化合价变化为:0→-1,依据得失电子守恒、原子个数守恒配平方程式;
②由题意可知,碘化钾与氯气反应生成碘酸钾和氯化氢,化学方程式KI+3Cl2+3H2O=KIO3+6HCl,计依据化学方程式计算消耗的氯气的物质的量,依据V=nVm计算标况下,消耗的氯气的气体,按最小值计算.
解答 解;①氯气具有强氧化性,向盛有KI溶液的试管中加入少许CCl4后滴加氯水,CCl4层变成紫色,说明生成I2,继续向试管中滴加氯水,振荡,CCl4层会逐渐变浅,最后变成无色,说明I2被进一步氧化,生成HIO3,同时氯气被还原为HCl,则碘元素化合价变化为:0→+5,氯气中氯元素化合价变化为:0→-1,1mol碘单质反应失去10mol电子,1mol氯气反应得到2mol电子,二者最小公倍数为10,依据氧化还原反应得失电子守恒,则氯气系数为5,碘单质系数为1,依据原子个数守恒,方程式:I2+5Cl2+6H2O=2HIO3+10HCl;
故答案为:I2、5Cl2、6H2O、2HIO3、10HCl;
②1000kg加碘食盐中含碘20g,KI+3Cl2+3H2O=KIO3+6HCl,
则:
KIO3~I~KI~3Cl2,
127g 3mol
20g n
解得n=$\frac{20×3}{127}$(mol),标况下氯气的气体V=nVm=$\frac{20×3}{127}$mol×22.4L/mol=10.58L;
故答案为:10.58.
点评 本题考查氧化还原反应方程式的配平、有关方程式的计算,明确氧化还原反应中得失电子守恒规律、氯气、碘的性质是解题关键,题目难度中等,侧重考查学生分析问题,解决问题能力.


 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 1mol Cl2与过量的铁反应,转移2NA个电子 | |
| B. | 1mol ${\;}_{92}^{235}$U核素含有235NA个中子 | |
| C. | 1mol N2与3mol H2混合充分反应,转移的电子数目为6NA | |
| D. | 常温下,0.1mol/L的NH4NO3溶液中氮原子数为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③④ | B. | ②④⑤ | C. | ①③ | D. | ①④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2CO3溶液和盐酸反应后溶液中的钠盐: | |
| B. | NaOH溶液与CO2反应后溶液中的钠盐: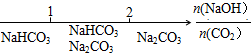 | |
| C. | Fe与稀硝酸反应的氧化产物: | |
| D. | AlCl3溶液中滴加氨水后铝元素的存在形式: |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 有等体积,浓度均为0.1mol/L的三种溶液:①HA溶液②HB溶液③NaHCO3溶液,已知将①、②分别与③混合,实验测得产生的CO2气体体积(v)随时间(t)变化的如图所示,下列说法正确的是( )
有等体积,浓度均为0.1mol/L的三种溶液:①HA溶液②HB溶液③NaHCO3溶液,已知将①、②分别与③混合,实验测得产生的CO2气体体积(v)随时间(t)变化的如图所示,下列说法正确的是( )| A. | 物质酸性的比较:HB>HA>H2CO3 | |
| B. | 反应结束后所得两溶液中,c(B-)>c(A-) | |
| C. | 上述三种溶液中由水电离的c(OH-)大小:NaHCO3溶液>HB溶液>HA溶液 | |
| D. | HA溶液和NaHCO3溶液反应所得溶液中:c(A-)+c(HA)=0.10mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 序号 | 第一组 | 第二组 | 第三组 | 第四组 |
| t/℃ | 30 | 40 | 50 | 80 |
| NH3生成量/(10-6mol) | 4.8 | 5.9 | 6.0 | 2.0 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com