
| 时间 | 开始 | 8小时 | 16小时 | 24小时 | 32小时 | 40小时 | 48小时 |
| pH | 5.0 | 4.8 | 4.5 | 4.3 | 4.2 | 4.0 | 4.0 |
分析 (1)酸雨形成的主要原因是大量燃烧化石燃料,产生二氧化硫,随雨降落形成;
(2)发生的反应为:2H2SO3+O2=2H2SO4,由弱酸生成强酸,酸性增强.
解答 解:(1)酸雨形成的主要原因是:大量燃烧化石燃料(煤和石油等),产生二氧化硫,随雨降落形成,
故答案为:酸雨样品中的H2SO3逐渐被氧化成H2SO4,使溶液的酸性增强;
(2)酸雨样品放置,发生的反应为:2H2SO3+O2=2H2SO4,酸雨样品中的H2SO3逐渐被氧化成H2SO4,使溶液的酸性增强,
故答案为:2H2SO3+O2=4H++SO42-.
点评 本题考查酸雨的形成、硫元素化合物的性质等,比较基础,注意对基础知识的理解掌握.


 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案 口算心算速算应用题系列答案
口算心算速算应用题系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验 | 温度/℃ | 起始时 | 平衡时 | |||
| n(CO)/mol | n(H2S)/mol | n(COS)/mol | n(H2)/mol | n(CO)/mol | ||
| 1 | 150 | 10.0 | 10.0 | 0 | 0 | 7.0 |
| 2 | 150 | 7.0 | 8.0 | 2.0 | 4.5 | a |
| 3 | 400 | 20.0 | 20.0 | 0 | 0 | 16.0 |
| A. | 上述反应是吸热反应 | |
| B. | 实验1 达平衡时,CO 的转化率为70% | |
| C. | 实验2 达平衡时,a<7.0 | |
| D. | 实验3 达平衡后,再充入1.0molH2,K 值增大,平衡逆向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
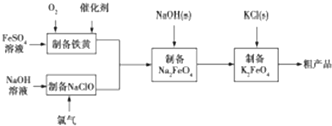
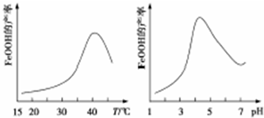
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 过滤时,慢慢地将液体直接倒入过滤器中 | |
| B. | 在食盐溶液蒸发结晶的过程中,当蒸发皿中出现较多量固体时即停止加热 | |
| C. | 酒精灯不慎碰倒起火时可用水扑灭 | |
| D. | 先在天平两个托盘上各放一张相同质量的纸,再把NaOH固体放在纸上称量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯使酸性KMnO4溶液褪色 | |
| B. | 乙烯使溴水褪色 | |
| C. | 点燃乙烯出现黑烟 | |
| D. | 甲烷与氯气的混合气体,光照一段时间后褪色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com