
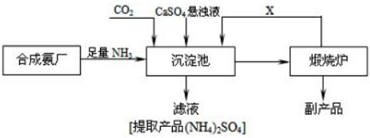
分析 工业合成氨的反应原理为N2+3H2 $?_{催化剂}^{高温、高压}$2NH3,将NH3和CO2通入沉淀池中并加入CaSO4,生成(NH4)2SO4和CaCO3,发生CaSO4+CO2+2NH3+H2O=CaCO3↓+(NH4)2SO4,CaCO3在煅烧炉中分解生成CO2和CaO,CO2可循环使用;
(1)工业合成氨所需氮气来自空气,常用蒸馏空气或者液化的物理方法获得;
(2)根据反应物、生成物及反应条件书写方程式;
(3)硫酸钙和二氧化碳、氨气、水反应生成碳酸钙和硫酸铵;
(4)A.氨气、二氧化碳、硫酸钙和水反应生成硫酸铵;
B.增大反应物浓度平衡正向移动;
C.氨气是反应物;
(5)在流程图中能作反应物和生成物的能循环利用;反应物能完全转化为生成物符合绿色化学理念且能充分利用资源;
(6)硫酸钙能用于生产水泥或石膏.
解答 解:工业合成氨的反应原理为N2+3H2 $?_{催化剂}^{高温、高压}$2NH3,将NH3和CO2通入沉淀池中并加入CaSO4,生成(NH4)2SO4和CaCO3,发生CaSO4+CO2+2NH3+H2O=CaCO3↓+(NH4)2SO4,CaCO3在煅烧炉中分解生成CO2和CaO,CO2可循环使用;
(1)工业合成氨所需氮气来自空气,常用蒸馏空气或者液化的物理方法获得,故答案为:蒸馏液态空气或者液化;
(2)在高温、高压、催化剂条件下氮气和氢气发生化合反应生成氨气,反应方程式为N2+3H2 $?_{催化剂}^{高温、高压}$2NH3,
故答案为:N2+3H2 $?_{催化剂}^{高温、高压}$2NH3;
(3)硫酸钙和二氧化碳、氨气、水反应生成碳酸钙和硫酸铵,反应方程式为CaSO4+CO2+2NH3+H2O=CaCO3↓+(NH4)2SO4,
故答案为:CaSO4+CO2+2NH3+H2O=CaCO3↓+(NH4)2SO4;
(4)A.氨气、二氧化碳、硫酸钙和水反应生成硫酸铵,所以氨气提供制各产品所需的氮元素
,故A正确;
B.增大反应物浓度平衡正向移动,所以增大CO32-的浓度促进反应发生
,故B正确;
C.氨气是反应物,而不是催化剂,故C错误;
故选AB;
(5)在流程图中能作反应物和生成物的能循环利用,可以循环利用的物质有CO2,反应物能完全转化为生成物符合绿色化学理念且能充分利用资源,所以优点是生成的CO2可循环使用,CaO可制备硫酸钙,没有废物生成,故答案为:CO2;生成的CO2可循环使用,CaO可制备硫酸钙,没有废物生成;
(6)硫酸钙能用于生产水泥或石膏,故答案为:生产水泥或石膏.
点评 本题考查物质的制备实验方案的设计,题目难度中等,本题注意把握物质的性质,注意根据反应物和生成物从质量守恒的角度书写反应的化学方程式.


 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
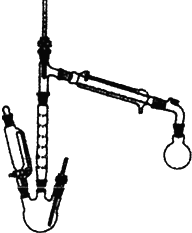 实验室也可用如图所示的装置制取少量乙酸乙酯.(已知乙酸乙酯在水中的溶解度较大,15℃时100g水中能溶解8.5g)
实验室也可用如图所示的装置制取少量乙酸乙酯.(已知乙酸乙酯在水中的溶解度较大,15℃时100g水中能溶解8.5g)查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
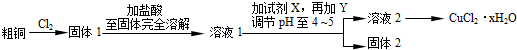
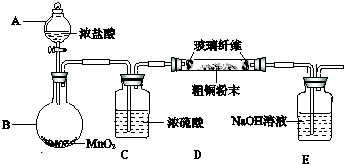
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
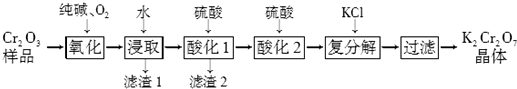
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | S的燃烧热为△H=-297.23kJ/mol | |
| B. | S(s)→S(g) 吸收热量 | |
| C. | S(g)+O2 (g)═SO2 (g) 放出的热量小于297.23kJ | |
| D. | 形成1mol SO2化学键所释放总能量大于断裂1molS(s)和1molO2 (g)的化学键所吸收的总能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Q1+Q2<2Q3 | B. | Q1+Q2>2Q3 | C. | Q1+Q2<Q3 | D. | Q1+Q2>Q3 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com