
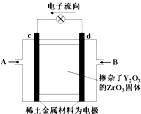
 如图所示,以稀土金属材料作惰性电极,在两极上分别通入甲烷与空气,电解质为掺杂了Y2O3的ZrO3固体,它在高温下能传导O2-.下列说法正确的是( )
如图所示,以稀土金属材料作惰性电极,在两极上分别通入甲烷与空气,电解质为掺杂了Y2O3的ZrO3固体,它在高温下能传导O2-.下列说法正确的是( )| A. | c电极名称为负极,气体A为空气 | |
| B. | d电极上发生反应:CH4-8e-+4O2-═CO2+2H2O | |
| C. | O2-向c电极移动 | |
| D. | 用此装置作电源电解精炼铜,d电极与粗铜相连 |
分析 由电子流向可知,d为负极、c为正极,负极发生氧化反应,正极发生还原反应,则B为甲烷、A为空气,正极上氧气获得电子生成O2-,通过掺杂了Y2O3的ZrO3固体移向负极,甲烷在负极失去电子与O2-结合生成二氧化碳与水.电解精炼铜时,粗铜作阳极,连接电源的正极,纯铜作阴极,连接电源的负极.
解答 解:由电子流向可知,d为负极、c为正极,负极发生氧化反应,正极发生还原反应,则B为甲烷、A为空气,正极上氧气获得电子生成O2-,通过掺杂了Y2O3的ZrO3固体移向负极,甲烷在负极失去电子.
A.c为原电池的正极,故A错误;
B.d为负极,发生氧化反应,甲烷在负极失去电子与O2-结合生成二氧化碳与水,电极反应式为:CH4-8e-+4O2-═CO2+2H2O,故B正确;
C.原电池中阴离子移向负极,O2-向d电极移动,故C错误;
D.电解精炼铜时,粗铜作阳极,连接电源的c电极,纯铜作阴极,连接电源的d电极,故D错误,
故选:B.
点评 本题考查电解原理及其应用,关键是根据电子流向判断电极,再结合氧化还原反应与电极反应式分析解答,理解掌握电解工作原理与电极判断方法.


科目:高中化学 来源: 题型:选择题
| A. | R原子核外一定有4个电子层 | |
| B. | R原子最外层电子数一定为4 | |
| C. | R的气态氧化物比电子层数相同的其他非金属元素的气态氢化物稳定 | |
| D. | R元素气态氢化物的化学式为H2R |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江西省高二上第一次月考化学卷(解析版) 题型:选择题
常温下,下列各组比值为1∶2的是
A.0.1 mol/L与0.2 mol/L醋酸溶液,c(H+)之比
B.0.1 mol/L Na2CO3溶液,c(CO32-)与c(Na+) 之比
之比
C.pH=10的Ba(OH)2溶液与氨水,溶质的物质的量浓度之比
D.pH=3的硫酸与醋酸溶液,c(SO42-)与c(CH3COO-)之比
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 “温室效应”是哥本哈根气候变化大会研究的环境问题之一.CO2是目前大气中含量最高的一种温室气体.因此,控制和治理CO2是解决“温室效应”的有效途径.
“温室效应”是哥本哈根气候变化大会研究的环境问题之一.CO2是目前大气中含量最高的一种温室气体.因此,控制和治理CO2是解决“温室效应”的有效途径.| 温度(K) CO2转化率(%) n(H2)/n(CO2) | 500 | 600 | 700 | 800 |
| 1.5 | 45 | 33 | 20 | 12 |
| 2 | 60 | 43 | 28 | 15 |
| 3 | 83 | 62 | 37 | 22 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 Ⅰ、某化学实验小组用0.50mol/L NaOH溶液和0.50mol/L硫酸溶液进行中和反应反应热的测定
Ⅰ、某化学实验小组用0.50mol/L NaOH溶液和0.50mol/L硫酸溶液进行中和反应反应热的测定查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 共价键 | C-C | C=C | C-H | H-H |
| 键能/KJ•mol-1 | 348 | 610 | 413 | 436 |
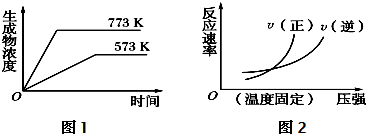
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 残留的固体 | 排放的气体 | |
| A | Na2CO3 | O2、CO2和H2O(g) |
| B | K2CO3 、Na2CO3 | O2和H2O(g) |
| C | NaOH、K2CO3 | O2和CO2 |
| D | Na2O2、NaOH、Na2CO3 | O2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
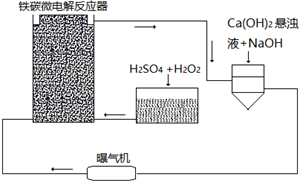
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com