
����Ŀ��������ڡ����ɵĻ�ѧ�ҡ�һ����˵:���ڻ�ĵ��������£�����������ˮ����ɥʧ��ԭ�е���ɫ�����һ�ֺ�ɫ���壻������ʹ���κθ����Լ��������ֺ�ɫ����Ҳ���Եõ������� �ù��̿ɱ�ʾΪ"2Hg+O2![]() 2HgO������˵���������
2HgO������˵���������
A. ���ø÷�Ӧ�ɴ��Բⶨ�����������ĺ���
B. ������������������仯��һ������Ļ�ѧ��Ӧ
C. ˮ���¶ȼ�������𣬿ɽ��������ɢ���ˮ���Ϸ�ֹ��Ⱦ
D. �Ʊ�Hg���ʿ��Բ����ȷֽⷨʹ���������ڸ����·ֽ��Ƶ�
���𰸡�B
��������A. ���ø÷�Ӧ�ɽ������е������빯��Ӧ������������ʣ�����ҪΪ�������ٷֽ�õ��������ɴ��Բⶨ�����������ĺ�����ѡ��A��ȷ��B. ������������������仯����ת���ķ�Ӧ������ͬ������һ������Ļ�ѧ��Ӧ��ѡ��B����C. ˮ���¶ȼ�������𣬿ɽ��������ɢ���ˮ���ϣ���Ӧ����������ֹ��Ⱦ��ѡ��C��ȷ��D. �Ʊ�Hg���ʿ��Բ����ȷֽⷨʹ���������ڸ����·ֽ����ɹ����������ɴ��Ƶù���ѡ��D��ȷ����ѡB��


 Сѧͬ�����������ܾ�ϵ�д�
Сѧͬ�����������ܾ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ָ����Ӧ�����ӷ���ʽ��ȷ����
A. ����ˮ��Ӧ��Na +2H2O![]() Na++2OH�C + H2��
Na++2OH�C + H2��
B. ��ⱥ��ʳ��ˮ��ȡ�ռ��������2Cl�C+2H2O![]() H2��+Cl2��+2OH�C
H2��+Cl2��+2OH�C
C. ������������Һ�м���ϡ���Ba2++OH�C + H+ + ![]()
![]() BaSO4��+H2O
BaSO4��+H2O
D. SO2����ˮ�����ԣ�SO2 + H2O == 2H+ + SO32-
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������ȷ���� ( )
A. FeCl3��Һ��Fe(OH)3������Fe(OH)3�����ı�����������û�ж����ЧӦ
B. ���ݷ�ɢϵ���ȶ��Դ�С��������Ϊ���塢��Һ����Һ
C. ���塢��ɢϵ�����������Ĵ�����ϵ����ͼ��ʾ

D. ���������ͼ���װ��10mLˮ���Թ��У��������γɽ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����жԷ�Ӧ2FeBr2��3Cl2��2FeCl3��2Br2���й�˵����ȷ���� �� ��
A. ��������Ԫ������Ԫ�� B. ����������Br2
C. ��ԭ������FeCl3 D. FeBr2������Ԫ�ض�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ɫ��Һ�з�����Ƭ�����������������������ڸ���Һ�п϶����ܴ������ڵ���( )
A. Mg2�� B. Na�� C. S2�� D. HCO3��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������Һ�ĵ絼��Խ��������Խǿ����0.100mol/L��NaOH��Һ�ֱ�ζ�10.00mLŨ�Ⱦ�Ϊ0.100mol/L�������CH3COOH��Һ�����ô�������õζ���������Һ�ĵ絼����ͼ��ʾ������˵����ȷ����
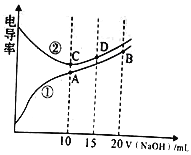
A. ���ߢٴ����ζ�HCl��Һ������
B. A����Һ��:c(CH3COO-)+c(OH-)+c(H+)=0.1mol/L
C. ����ͬ�¶��£�A��B��C������Һ��ˮ�ĵ���̶�: C<B<A
D. D����Һ��:2c(Na+)=3c(Cl-)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ba(OH)2��NaOH�����Һ�л���ͨ��CO2���������������ɳ������ʵ�����ͨ��CO2��������V����״�����Ĺ�ϵ��ͼ��ʾ�����н��۲���ȷ����

A. ԭ�������n[Ba(OH)2]��n[NaOH] =1:2
B. ����������p���ֵΪ90
C. b��ʱ����ΪNaHCO3
D. ab�η�����Ӧ�����ӷ���ʽ����Ϊ��CO2+2OH- = H2O+CO32-��CO2+H2O+ CO32-=2HCO3-
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������(ClNO)����NO��Cl2��ͨ�������·�Ӧ�õ�����ѧ����ʽΪ:2NO(g)+Cl2(g)![]() 2ClNO(g)��
2ClNO(g)��
(1)��һ���¶��£��÷�Ӧ��һ�����ܱ������дﵽƽ�����ͨ��Cl2���淴Ӧ����____(�������١�����)��
(2)��֪���ֻ�ѧ���ļ����������±�(NO�ĽṹΪ:N��O���������ȵĽṹΪCl-N=O)
��ѧ�� | N��O | Cl-Cl | Cl-N | N=O |
����(kJ/mol) | 630 | 243 | a | 607 |
2NO(g)+Cl2(g)![]() 2ClNO(g) ��H=-111kJ/mol��a=______��
2ClNO(g) ��H=-111kJ/mol��a=______��
(3)��1L�ĺ����ܱ������г���2molNO(g)��1molCl2(g)���ڲ�ͬ�¶��²��c(ClNO)��ʱ��Ĺ�ϵ��ͼA:
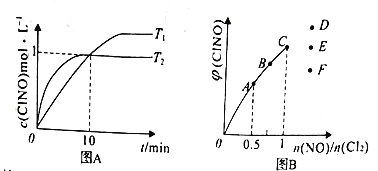
�ٸ÷�Ӧ��T1______T2(�>��<����=��)��
�ڷ�Ӧ��ʼ��10minʱNO��ƽ����Ӧ����v(NO)=_______mol/(L.min)��
��T2ʱ�÷�Ӧ��ƽ�ⳣ��K=________��
(4)һ���������ں��º��ݵ��ܱ������а�һ����������NO(g)��Cl2(g)��ƽ��ʱClNO�����������n(NO)/n(Cl2)�ı仯ͼ����ͼB,��A��B��C��״̬�У�NO��ת����������_____�㣬��n(NO)/n(Cl2)=1.5ʱ���ﵽƽ��״̬ClNO���������������D��E��F�����е�____�㡣
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ˮ��������ԴȪ��������ˮ�ĺ���Լռ65%�������й�ˮ���������������
A. ��������Ӫ�����ʺʹ�л�����Ϊ����ˮ
B. ���ˮ�ǹ���ϸ���ṹ����ɳɷ�֮һ
C. �ļ�ϸ��ֻ�����ˮ��ѪҺֻ������ˮ
D. ����ˮ�ͽ��ˮ�ı���Ӱ���³´�л��ǿ��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com