
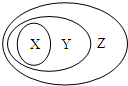
 用图表示的一些物质或概念间的从属关系中错误的是( )
用图表示的一些物质或概念间的从属关系中错误的是( )| X | Y | Z | |
| A | 苯的同系物 | 芳香烃 | 芳香族化合物 |
| B | 钢铁 | 合金 | 混合物 |
| C | 电解质 | 离子化合物 | 化合物 |
| D | 碱性氧化物 | 金属氧化物 | 氧化物 |
| A. | A | B. | B | C. | C | D. | D |
分析 A、苯的同系物是含有一个苯环,与饱和烃基相连,组成相差CH2的物质,芳香烃是含苯环的烃,芳香族化合物是含苯环的化合物;
B、钢铁是合金,属于混合物;
C、碱性氧化物是能和酸反应生成盐和水的氧化物;
D、电解质是在水溶液中或熔融状态下能导电的化合物.
解答 解:A、苯的同系物是含有一个苯环,与饱和烃基相连,组成相差CH2的物质,芳香烃是含苯环的烃,芳香族化合物是含苯环的化合物,苯的同系物属于芳香烃,芳香烃属于芳香族化合物,故A正确;
B、钢铁属于合金,合金属于混合物,故B正确;
C、电解质是在水溶液中或熔融状态下能导电的化合物,包括所有的离子化合物和部分共价化合物,电解质不全包含在离子化合物中,离子化合物属于电解质,故C错误.
D、碱性氧化物是能和酸反应生成盐和水的氧化物,一定是金属氧化物;金属氧化物是一种元素是金属元素的氧化物,即金属氧化物属于氧化物,故D正确;
故选C.
点评 本题考查了物质类别之间的归属关系,难度不大,注意从概念角度来分析,注意物质分类依据和物质组成特征.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 原子半径逐渐减小 | B. | 最外层电子数逐渐增多 | ||
| C. | 最高正化合价逐渐增大 | D. | 元素的非金属性逐渐增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
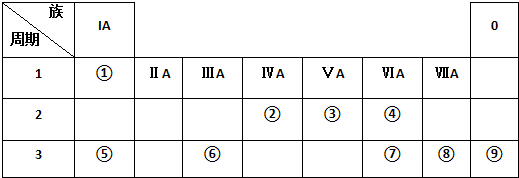
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可以用NaOH溶液鉴别MgCl2和AlCl3 | |
| B. | 可以用溴水鉴别甲烷和乙烯 | |
| C. | 可以用分液漏斗分离乙酸和乙醇 | |
| D. | 可以用NaOH溶液除去苯中少量的Br2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 无水乙酸和乙醇共热制取乙酸乙酯 | |
| B. | 用制取氢气的装置制取乙炔 | |
| C. | 将铜丝在酒精灯上加热后,立即伸人无水乙醇中,铜丝恢复原来的红色 | |
| D. | 淀粉用酸催化水解后的溶液加入新制银氨溶液,水浴加热,可看到有银镜出现 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铪-185的原子核内有72个电子 | B. | 其中子数比电子数多41 | ||
| C. | 是铪-180的一种新的同素异形体 | D. | 铪-185的原子核内有185个质子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
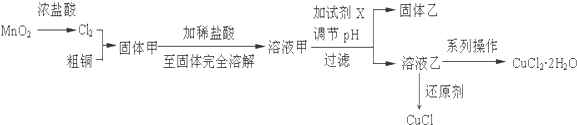
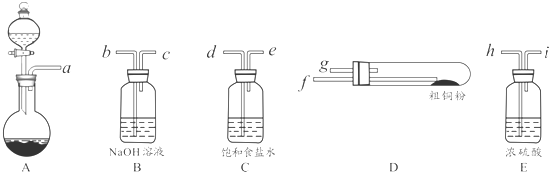
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com