

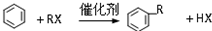 A具有和苯相似的性质.
A具有和苯相似的性质. 2HCHO+2H2O;
2HCHO+2H2O;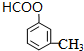 、
、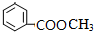 ;
; .
. 分析 一定条件下,氢气和一氧化碳反应生成甲醇,甲醇氧化生成E为甲醛,甲醛氧化得F为甲酸,甲酸与甲醇发生酯化得G为甲酸甲酯,甲醇和氢溴酸发生取代反应生成一溴甲烷,在催化剂条件下,一溴甲烷和和A反应生成B,B反应生成C,C反应生成D,根据A的分子式知,A中含有醇羟基和亚甲基或甲基和酚羟基,根据D的结构简式知,A中含有甲基和酚羟基,酚发生取代反应时取代位置为酚羟基的邻对位,根据D知,A是间甲基苯酚,间甲基苯酚和一溴甲烷反应生成B(2,5-二甲基苯酚),2,5-二甲基苯酚和氢气发生加成反应生成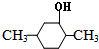 ,
, 发生消去反应生成
发生消去反应生成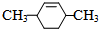 ,
, 和丙烯发生加成反应生成M,M的结构简式为:
和丙烯发生加成反应生成M,M的结构简式为: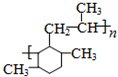 ,根据有机物的结构和性质分析解答.
,根据有机物的结构和性质分析解答.
解答 解:一定条件下,氢气和一氧化碳反应生成甲醇,甲醇氧化生成E为甲醛,甲醛氧化得F为甲酸,甲酸与甲醇发生酯化得G为甲酸甲酯,甲醇和氢溴酸发生取代反应生成一溴甲烷,在催化剂条件下,一溴甲烷和和A反应生成B,B反应生成C,C反应生成D,根据A的分子式知,A中含有醇羟基和亚甲基或甲基和酚羟基,根据D的结构简式知,A中含有甲基和酚羟基,酚发生取代反应时取代位置为酚羟基的邻对位,根据D知,A是间甲基苯酚,间甲基苯酚和一溴甲烷反应生成B(2,5-二甲基苯酚),2,5-二甲基苯酚和氢气发生加成反应生成 ,
, 发生消去反应生成
发生消去反应生成 ,
, 和丙烯发生加成反应生成M,M的结构简式为:
和丙烯发生加成反应生成M,M的结构简式为: ,
,
(1)a.甲醇可发生取代、氧化反应但不能发生消去,故错误;
b.甲醇分子间脱水生成CH3OCH3,故正确;
c.甲醇有毒性,可使人双目失明,故正确;
d.甲醇与乙醇都有一个羟基,组成相关一个CH2;所以属于同系物,故正确;
故选a;
(2)甲醇转化为甲醛的化学方程式为 2CH3OH+O2 2HCHO+2H2O,
2HCHO+2H2O,
故答案为:2CH3OH+O2 2HCHO+2H2O;
2HCHO+2H2O;
(3)根据上面的分析可知,C生成D的反应类型是 消去反应,F为甲酸,F生成G的反应甲酸与甲醇发酯化反应生成甲酸甲酯,反应条件为浓硫酸、加热,
故答案为:消去反应;浓硫酸、加热;
(4)G为甲酸甲酯,G的结构简式 HCOOCH3,分子式为C8H8O2的有机物含有和G相同的官能团即含有酯基,其中2种可能的结构简式为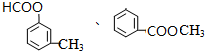 ,
,
故答案为:甲酸甲酯; 、
、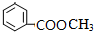 ;
;
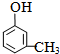
(5)取1.08g A物质(式量108)的物质的量=$\frac{1.08g}{108g/mol}$,与足量饱和溴水完全反应能生成2.66g白色沉淀,根据碳原子守恒知,白色沉淀的物质的量是0.01mol,则白色沉淀的摩尔质量是266g/mol,A的式量和白色沉淀的式量相差158,则溴原子取代酚羟基的邻对位,所以A的结构简式为: ,
,
故答案为: .
.
点评 本题考查有机物的推断,明确物质反应前后官能团的变化是解本题关键,根据官能团的变化确定反应条件,注意结合题给信息进行分析解答,难度较大.


 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案科目:高中化学 来源: 题型:选择题
| A. | 加入Al能放出H2的溶液中:ClO-、HCO${\;}_{3}^{-}$、SO${\;}_{4}^{2-}$、NH${\;}_{4}^{+}$ | |
| B. | pH=2的溶液中:Fe2+、Na+、Mg2+、NO${\;}_{3}^{-}$ | |
| C. | 能使KSCN溶液变红的溶液中:Na+、I-、NO${\;}_{3}^{-}$、HCO${\;}_{3}^{-}$ | |
| D. | 由水电离出的c(OH-)=1.0×10-13mol•L-1的溶液中:Na+、Ba2+、Cl-、Br- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 分子式 | 外观 | 热分解温度 | 熔点 | 溶解性 |
| CO(NH2)2•H2O2 | 白色晶体 | 45℃ | 75-85℃ | 易溶于水、有机溶剂 |
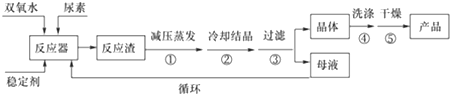
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某溶液中,可能含有下表所列离子中的某几种:
某溶液中,可能含有下表所列离子中的某几种:| 阳离子 | Al3+、Mg2+、NH4+、Na+ |
| 阴离子 | CO32-、SiO32-、[Al(OH)4]-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入稀盐酸产生无色气体,将该气体通入澄清石灰水中变浑浊,则一定有CO32- | |
| B. | 加入烧碱溶液并加热,产生的气体能使湿润的红色石蕊试纸变蓝,则一定有 NH4+ | |
| C. | 加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,则一定有SO42- | |
| D. | 加入Na2CO3 溶液产生白色沉淀,再加盐酸,白色沉淀消失,则一定有Ca2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解饱和NaOH溶液时溶液的pH变大 | |
| B. | 在镀件上电镀铜时,可以不用金属铜做阳极,只要溶液中存在Cu2+就可以 | |
| C. | 电解稀硫酸制O2、H2时,铜做阳极 | |
| D. | 铝-空气燃料电池通常以NaOH溶液为电解液,电池在工作过程中电解液的pH保持不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 铅蓄电池的A极为正极,电极材料为PbO2 | |
| B. | 铅蓄电池放电时负极质量增加 | |
| C. | 该电解池的阴极反应为:2 NO3-+6H2O+10e-═N2↑+2OH- | |
| D. | 若电路中流过2mol电子,则阳极室溶液质量减少32g(忽略气体的溶液) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .它与硫酸反应的化学方程式为K4Fe(CN)6+6H2SO4+6H2O$\frac{\underline{\;\;△\;\;}}{\;}$2K2SO4+FeSO4+3(NH4)2SO4+6CO↑
.它与硫酸反应的化学方程式为K4Fe(CN)6+6H2SO4+6H2O$\frac{\underline{\;\;△\;\;}}{\;}$2K2SO4+FeSO4+3(NH4)2SO4+6CO↑查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com