
【题目】二硫化钨(WS2,WS2中W的化合价为+4)可用作润滑剂及石油化工领域中的催化剂。由钨铁矿(其主要成分是FeWO4,还含少量Al2O3)制备二硫化钨的工艺流程如下:
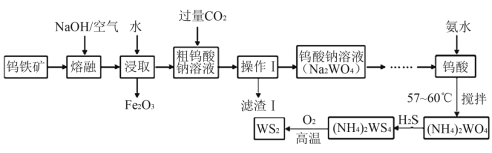
请回答下列问题:
(1)“滤渣Ⅰ”的化学式为__________;
(2)提高“熔融”速率的措施有_____________________(写一条即可);
(3)用离子方程式表示通入过量CO2的主要目的是:________________________;
(4)钨酸与氨水反应时控制温度为58℃,温度不宜太高,其原因是___________。
(5)已知2(NH4)2WS4+3O2![]() 2WS2+4NH3+2S+2SO2+2H2O,若该反应转移了8 mol电子,则生成的气体产物在标准状况下的体积为______L;
2WS2+4NH3+2S+2SO2+2H2O,若该反应转移了8 mol电子,则生成的气体产物在标准状况下的体积为______L;
(6)常温下,Ksp(CaWO4) =1×10-10。在钨酸钠溶液中滴加澄清石灰水产生钨酸钙沉淀,当溶液中pCa=-1g c(Ca2+)=4,c(WO42-)=_____mol/L。
【答案】Al(OH)3 增大氧气的通入量、搅拌、增大NaOH溶液的浓度等任意一种 AlO2-+CO2+2H2O=Al(OH)3↓+HCO3- 一水合氨不稳定,受热分解 67.2 1×10-6
【解析】
由流程可知,钨酸亚铁和氢氧化钠、氧气反应生成氧化铁和钨酸钠,Al2O3和NaOH反应生成NaAlO2,水浸时,可除去不溶于水的氧化铁,向粗钨酸钠溶液中通入过量CO2,经过滤后得到的滤液含钨酸钠,滤渣I的主要成份是Al(OH)3,滤液再经酸化得钨酸,向钨酸中加入氨水并控制温度得钨酸铵,继续通入H2S气体,生成(NH4)2WS4,最后将(NH4)2WS4在氧气中高温加热即可得到WS2。
(1)粗钨酸钠溶液中含有NaAlO2,向其中通入过量CO2,NaAlO2与CO2、H2O反应产生Al(OH)3沉淀,所以“滤渣Ⅰ”为Al(OH)3;
(2)熔融的钨铁矿与NaOH溶液、氧气会发生反应:FeWO4+8NaOH+O2![]() 2Fe2O3+Na2WO4+4H2O,能够提高该反应速率的因素有增大氧气的通入量、搅拌、增大NaOH溶液的浓度等;
2Fe2O3+Na2WO4+4H2O,能够提高该反应速率的因素有增大氧气的通入量、搅拌、增大NaOH溶液的浓度等;
(3)在含有NaAlO2的溶液中通入过量CO2气体,生成Al(OH)3沉淀和NaHCO3溶液,反应的离子方程式为:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-;
(4)钨酸与氨水反应时控制温度为58℃,温度太高,氨水中的一水合氨分解产生的氨气逸出,导致反应物浓度降低,不利于反应的进行;
(5)在反应2(NH4)2WS4+3O2![]() 2WS2+4NH3+2S+2SO2+2H2O中,(NH4)2WS4中+6价W被还原为+4价的WS2,-2价S元素被氧化成0价的S单质,-2价S元素被氧化成+4价的SO2,O2得到电子被还原为-2价的O,每反应生成2 mol WS2,同时得到4 mol NH3、2 mol SO2气体,共6 mol气体,反应中共转移16 mol电子,若该反应转移了8 mol电子,则反应产生气体的物质的量是3 mol,反应产生气体在标准状况下的体积V=3 mol×22.4 L/mol=67.2 L;
2WS2+4NH3+2S+2SO2+2H2O中,(NH4)2WS4中+6价W被还原为+4价的WS2,-2价S元素被氧化成0价的S单质,-2价S元素被氧化成+4价的SO2,O2得到电子被还原为-2价的O,每反应生成2 mol WS2,同时得到4 mol NH3、2 mol SO2气体,共6 mol气体,反应中共转移16 mol电子,若该反应转移了8 mol电子,则反应产生气体的物质的量是3 mol,反应产生气体在标准状况下的体积V=3 mol×22.4 L/mol=67.2 L;
(6)常温下,Ksp(CaWO4) =1×10-10。在钨酸钠溶液中滴加澄清石灰水产生钨酸钙沉淀,当溶液中pCa=-1g c(Ca2+)=4,c(Ca2+)=1×10-4 mol/L,c(WO42-)=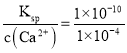 mol/L=1×10-6 mol/L。
mol/L=1×10-6 mol/L。


 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.硬脂酸甘油酯在烧碱条件下发生水解反应,得到的硬脂酸是肥皂的主要成分
B.检验淀粉在稀硫酸催化条件下是否水解的方法是:取适量水解液于试管中,加入少量新制![]() 悬浊液,加热,观察是否有砖红色沉淀
悬浊液,加热,观察是否有砖红色沉淀
C.向鸡蛋清溶液中加入浓NaOH溶液,可使蛋白质发生变性,从而失去生理功能
D.氨基酸分子中含羧基和氨基原子团,是高分子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高温下,超氧化钾晶体(KO2)呈立方体结构。如图为超氧化钾晶体的一个晶胞。则下列有关说法正确的是( )

A. KO2中只存在离子键
B. 晶体中与每个K+距离最近的O2-有6个
C. 晶体中,所有原子之间都以离子键相结合
D. 超氧化钾的化学式为KO2,每个晶胞含有1个K+和1个O2-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,pH 均为2的两种一元酸HA和HB各1mL,分别加水稀释,pH 随溶液体积的变化曲线如图所示。下列说法正确的是
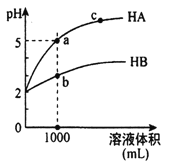
A. HA的酸性比HB的酸性弱
B. a点溶液的导电性比c点溶液的导电性弱
C. 若两溶液加水稀释,则所有离子的浓度都减小
D. 对a、b两点溶液同时升高温度,则c(A-)/c(B-)减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)浓度为0.1mol/L醋酸钠溶液中质子守恒表达式为_________;
(2)等浓度的NaHCO3 、Na2CO3混合溶液中的物料守恒表达式为__________;
(3)硫代硫酸钠(Na2S2O3)溶液与稀硫酸反应的离子方程式为__________;
(4) Fe2(SO4)3溶液显酸性,用离子方程式表示其原因___________;
(5)常温下,NaHCO3溶液中离子浓度由大到小的顺序是___________________________
(6)在25 ℃下,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合, 当溶液中c(![]() )=c(Cl-),则溶液显________(填“酸”“碱”或“中”)性;用含a的代数式表示NH3·H2O的电离常数Kb=________。
)=c(Cl-),则溶液显________(填“酸”“碱”或“中”)性;用含a的代数式表示NH3·H2O的电离常数Kb=________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿伏加德罗常数的值为NA,下列说法正确的是
A. 标准状况下,2.24LCH3OH分子中共价键的数目为0.5NA
B. 1molNa2O2与足量CO2充分反应,转移的电子数为2 NA
C. 25℃1LpH=12的Na2CO3溶液中,由水电离出H+的数目为0.01NA
D. 0.1molH2和0.1molI2于密闭容器中充分反应后,HI分子总数为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应A2(g) + 2B2(g)![]() 2AB2(g) ΔH < 0,列说法正确的是 ( )
2AB2(g) ΔH < 0,列说法正确的是 ( )
A.升高温度,正向反应速率增加,逆向反应速率减小
B.达到平衡后,降低温度或减小压强都有利于该反应平衡正向移动
C.达到平衡后,升高温度或增大压强都有利于该反应平衡正向移动
D.升高温度有利于反应速率增加,从而缩短达到平衡的时间
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是
A.实验室制氢气,为了加快反应速率,可向稀H2SO4中滴加少量Cu(NO3)2溶液
B.为处理锅炉水垢中的CaSO4,可先用饱和Na2CO3溶液浸泡,再加入盐酸溶解
C.反应N2(g)+3H2(g)![]() 2NH3(g)△H<0平衡时,其他条件不变,升高温度,再次达到平衡时氢气转化率增大
2NH3(g)△H<0平衡时,其他条件不变,升高温度,再次达到平衡时氢气转化率增大
D.吸热反应“TiO2(s)+2Cl2(g)=TiCl4(g)+O2(g)”在一定条件下可自发进行,则该反应的△S<0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸(H2C2O4,二元弱酸)与草酸盐在实验和工业生产中都起着重要的作用。
(1)硫酸酸化的KMnO4能与Na2C2O4溶液反应生成Mn2+和CO2,该反应的离子方程式为__________;
(2)分别使10 mL pH=3的H2C2O4溶液和100 mL pH=4的H2C2O4溶液全部转化为Na2C2O4,所需等浓度的NaOH溶液的体积为V1和V2,则V1_____V2(填“>”“<”或“=”)
(3)常温下,用0.1000 mol/L NaOH溶液滴定20.00 mL某未知浓度的H2C2O4溶液,滴定曲线如图,c点所示溶液中:![]()

①该草酸溶液的物质的量浓度为__________;
②a点所示溶液中各离子的浓度由大到小的顺序为_________________;
(4)已知:某温度时,Ksp(FeC2O4)=2.0×10-7,Ksp(CaC2O4)=2.5×10-9。
①此温度下,CaC2O4饱和溶液的物质的量浓度为________;
②此温度下,向Na2C2O4溶液中加入FeCl2与CaCl2,当两种沉淀共存时,溶液中c(Fe2+):c(Ca2+)=_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com