
2- 4 |

| n |
| V |
| m |
| MV |
| n |
| V |
| m |
| MV |


 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案科目:高中化学 来源: 题型:
 现有FeCl3、FeCl2、CuCl2的混合溶液1L,将0.70mol的铁粉慢慢加入混合液中并充分搅拌,溶液中的三种金属阳离子的物质的量随铁粉加入量的变化曲线如图所示,D点坐标是(0.4,0),H点坐标是(0.7,0.2).
现有FeCl3、FeCl2、CuCl2的混合溶液1L,将0.70mol的铁粉慢慢加入混合液中并充分搅拌,溶液中的三种金属阳离子的物质的量随铁粉加入量的变化曲线如图所示,D点坐标是(0.4,0),H点坐标是(0.7,0.2).查看答案和解析>>
科目:高中化学 来源: 题型:
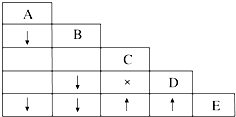 有五瓶损坏标签的试剂,分别盛有AgNO3溶液、稀硝酸、盐酸、BaCl2溶液、K2CO3溶液,为了确定各瓶中是什么试剂,将它们任意编号为A、B、C、D、E,用小试管各取少量,多次进行两两混合反应,反应现象如表所示.表中“↓”表示生成沉淀,“↑”表示生成气体,“×”表示没有明显现象,空格表示实验未做.
有五瓶损坏标签的试剂,分别盛有AgNO3溶液、稀硝酸、盐酸、BaCl2溶液、K2CO3溶液,为了确定各瓶中是什么试剂,将它们任意编号为A、B、C、D、E,用小试管各取少量,多次进行两两混合反应,反应现象如表所示.表中“↓”表示生成沉淀,“↑”表示生成气体,“×”表示没有明显现象,空格表示实验未做.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、某溶液中加入BaCl2溶液,产生白色沉淀,加入HNO3后,白色沉淀不溶解,也无其他现象,说明该溶液中一定含有SO42- |
| B、某溶液中加盐酸产生刺激性气味的无色气体,该气体能使品红溶液褪色,说明该溶液中一定含有SO32- |
| C、某溶液中加盐酸产生无色气体,该气体能使澄清的石灰水变浑浊,说明该溶液中一定含有CO32- |
| D、取少量久置的Na2SO3样品于试管中加水溶解,再加入足量盐酸有气体产生,然后再加入BaCl2溶液有白色沉淀产生,说明Na2SO3样品已部分被氧化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 欲用含有少量氯化钙的氯化钠固体,配制100mL a mol/L的氯化钠溶液,设计了下面的操作方案.根据方案操作步骤回答下列问题:
欲用含有少量氯化钙的氯化钠固体,配制100mL a mol/L的氯化钠溶液,设计了下面的操作方案.根据方案操作步骤回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氯气、活性炭都能使品红溶液褪色,它们的漂白原理相同 |
| B、滴加石蕊试液显红色的溶液:Fe3+、NH4+、I-可能大量共存 |
| C、某溶液中加入盐酸酸化的氯化钡产生白色沉淀,原溶液中一定含有SO42- |
| D、Fe(N03)2溶液中滴加少量稀硫酸会变黄色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com