
分析 气体的物质的量=$\frac{VL}{22.4L/mol}$=$\frac{V}{22.4}$mol,气体质量=$\frac{V}{22.4}$mol×Mg/mol=$\frac{VM}{22.4}$g,水质量为300g,溶液质量=$\frac{VM}{22.4}$g+300g,溶液体积=$\frac{\frac{VM}{22.4}+300}{1000ρ}$L,根据c=$\frac{n}{V}$计算物质的量浓度.
解答 解:气体的物质的量=$\frac{VL}{22.4L/mol}$=$\frac{V}{22.4}$mol,气体质量=$\frac{V}{22.4}$mol×Mg/mol=$\frac{VM}{22.4}$g,水质量为300g,溶液质量=$\frac{VM}{22.4}$g+300g,溶液体积=$\frac{\frac{VM}{22.4}+300}{1000ρ}$L,c=$\frac{n}{V}$=
$\frac{\frac{V}{22.4}mol}{\frac{\frac{VM}{22.4}+300}{1000ρ}L}$=$\frac{1000ρV}{VM+6720}$mol/L,故答案为:$\frac{1000ρV}{VM+6720}$mol/L.
点评 本题考查物质的量浓度计算,为高频考点,侧重考查学生分析计算能力,明确各个物理量之间的关系是解本题关键,注意溶液质量计算方法,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| CO | H2O | CO2 | H2 |
| 0.5mol | 8.5mol | 2.0mol | 2.0mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
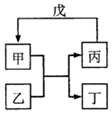 甲、乙、丙、丁、戊的相互转化关系如图所示(反应条件略去,箭头表示一步转化).下列各物质中,不满足如图转化关系的是( )
甲、乙、丙、丁、戊的相互转化关系如图所示(反应条件略去,箭头表示一步转化).下列各物质中,不满足如图转化关系的是( ) | 甲 | 乙 | 丙 | 戊 | |
| ① | SiO2 | NaOH | Na2SiO3 | CO2 |
| ② | Fe | H2O | Fe2O3 | H2 |
| ③ | Al(OH)3 | NaOH溶液 | NaAlO2溶液 | 过量CO2 |
| ④ | Na2O2 | CO2 | O2 | Na |
| A. | ①③ | B. | ①② | C. | ②④ | D. | ①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 醋酸 | B. | 碳酸钠溶液 | C. | CuSO4溶液 | D. | KCl溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
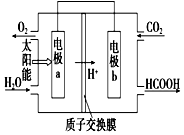 燃料的使用和防污染是社会发展中一个无法回避的矛盾话题.
燃料的使用和防污染是社会发展中一个无法回避的矛盾话题.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验剩余的药品不能放回原试剂瓶 | |
| B. | 滴管不能交叉使用 | |
| C. | 气体实验装置在实验前进行气密性检查 | |
| D. | 可燃性气体的验纯 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com