
 ;六元环状化合物I
;六元环状化合物I .
. .
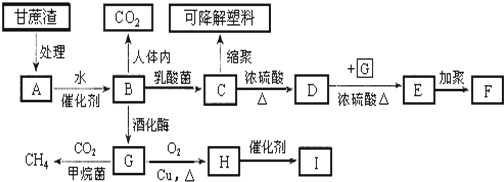
.分析 甘蔗渣处理之后得到纤维素,纤维素水解的最终产物为葡萄糖,葡萄糖在酒化酶的作用下生成G为CH3CH2OH,H为CH3CHO,H的三聚合物I也是一种六元环状化合物,I应为 ,葡萄糖在乳酸菌的作用下生成C为乳酸,即CH3CHOHCOOH;D能使溴水褪色,说明含有不饱和键,C发生消去反应生成D,D为CH2=CHCOOH,D和乙醇发生酯化反应生成E,为CH2=CHCOOCH2CH3,F为
,葡萄糖在乳酸菌的作用下生成C为乳酸,即CH3CHOHCOOH;D能使溴水褪色,说明含有不饱和键,C发生消去反应生成D,D为CH2=CHCOOH,D和乙醇发生酯化反应生成E,为CH2=CHCOOCH2CH3,F为 ,结合题目分析解答.
,结合题目分析解答.
解答 解:甘蔗渣处理之后得到纤维素,纤维素水解的最终产物为葡萄糖,葡萄糖在酒化酶的作用下生成G为CH3CH2OH,H为CH3CHO,H的三聚合物I也是一种六元环状化合物,I应为 ,葡萄糖在乳酸菌的作用下生成C为乳酸,即CH3CHOHCOOH;D能使溴水褪色,说明含有不饱和键,C发生消去反应生成D,D为CH2=CHCOOH,D和乙醇发生酯化反应生成E,为CH2=CHCOOCH2CH3,F为
,葡萄糖在乳酸菌的作用下生成C为乳酸,即CH3CHOHCOOH;D能使溴水褪色,说明含有不饱和键,C发生消去反应生成D,D为CH2=CHCOOH,D和乙醇发生酯化反应生成E,为CH2=CHCOOCH2CH3,F为 ,
,
(1)F、I结构简式分别为 、
、 ,故答案为:
,故答案为: ;
; ;
;
(2)C发生消去反应生成D,所以反应类型是消去反应,故答案为:消去反应;
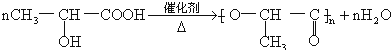
(3)纤维素发生水解反应生成葡萄糖,反应方程式为,
2-羟基丙酸发生缩聚反应生成高分子化合物,反应方程式为 ,
,
故答案为:;
 ;
;
(4)H为CH3CHO,其官能团名称是醛基,可以用新制氢氧化铜悬浊液或银氨溶液检验醛基,
故答案为:醛基;新制氢氧化铜悬浊液(斐林Fehling试剂)或银氨溶液(硝酸银的氨溶液、托伦Tollens试剂);
(5)E为CH2=CHCOOCH2CH3,E的同分异构体与E具有相同官能团说明含有碳碳双键和酯基,
如果是甲酸酯,如果醇的碳链为C=C-C-C,有4种;
如果醇的碳链为C-C=C-C,有2种;
如果醇的碳链为C=C(C)-C,有3种;
如果是乙酸酯,醇的碳链为C=C-C,有3种;
如果是烯酸酯,
如果烯酸烃基为C=C-C,有3种;
所以符合条件的有15种,其中一种结构简式为CH3COOCH=CHCH3,
故答案为:15;CH3COOCH=CHCH3.
点评 本题考查有机物推断,为高频考点,正确推断各物质结构简式是解本题关键,注意结合题给信息、反应条件进行推断,知道常见有机物官能团及其性质关系,难点是(5)题同分异构体种类判断,要考虑官能团位置异构、碳链异构,题目难度中等.


 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案科目:高中化学 来源: 题型:解答题
 .
. +NaOH$→_{△}^{水}$
+NaOH$→_{△}^{水}$ +NaCl.
+NaCl.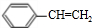 $\stackrel{催化剂}{→}$
$\stackrel{催化剂}{→}$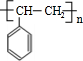 .
.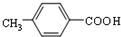 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,11.2LN2和NO的混合气体所含的原子数为NA | |
| B. | 1mol C8H18分子中,共价键总数为25NA | |
| C. | 标准状况下,22.4L盐酸含有nA个HCl分子 | |
| D. | 含0.1molH2O2的水溶液跟MnO2充分作用,反应过程中转移的电子总数为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl2、SO2、NH3的水溶液虽都能够导电,但它们均属于非电解质 | |
| B. | 在浓硝酸中加入等体积浓硫酸后,立即加入铝片,铝片发生钝化 | |
| C. | 任何可逆反应,其平衡常数越大,反应速率、反应物的转化率就越大 | |
| D. | 电解饱和食盐水的过程中,水的电离平衡正向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 规律 | 结论 |
| A | 非金属性越强,其气态氢化物越稳定 | 稳定性:NH3>PH3 |
| B | 反应物浓度越大,反应速率越快 | 常温下,相同的铁片中分别加入足量的浓、稀硝酸,浓硝酸中铁片先溶解完 |
| C | 结构和组成相似的物质,沸点随相对分子质量增大而升高 | HF沸点低于HCl |
| D | 浓硫酸不能干燥具有还原性的气体 | 浓硫酸不可以干燥SO2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
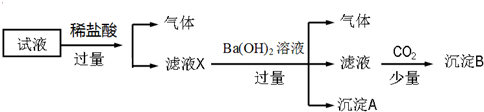
| A. | 无法确定原试液中是否含有Fe3+、K+ | |
| B. | 滤液X中大量存在的阳离子有NH4+、Fe3+、H+和Al3+ | |
| C. | 无法确定沉淀B的成分 | |
| D. | 原溶液中一定存在的离子为NH4+、Fe2+、NO3-、SO42- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com