
在2L密闭容器内充入5 mol A和2.5 mol B使之发生反应:3A(g)+B(g) ![]() C(g)+2D(g),经过5min反应达到平衡,经测定C的平均反应速率为0.1mol/(L?min)。下列叙述中正确的是 ( )
C(g)+2D(g),经过5min反应达到平衡,经测定C的平均反应速率为0.1mol/(L?min)。下列叙述中正确的是 ( )
A.恢复至原温度,容器内压强增大 B.A的平均反应速率为0.1mol/(L?min)
C.达到平衡时,B比A的转化率小 D.B的平衡浓度为0.25mol/L
科目:高中化学 来源: 题型:
 (2010?泰州二模)下图为工业制备硝酸的设备示意图,其生产过程中发生的反应主要有:
(2010?泰州二模)下图为工业制备硝酸的设备示意图,其生产过程中发生的反应主要有:查看答案和解析>>
科目:高中化学 来源: 题型:
右图为工业制备硝酸的设备示意图,其生产过程中发生的反应主要有:
①4NH3(g)+5O2(g)4NO(g)+6H2O(l) △H<0
②2NO(g)+O2(g)2NO2(g) △H<0
③3NO2(g)+H2O(l)2HNO3(l)+NO(g) △H<0
⑴能使吸收塔内反应速率增大,且能提高HNO3产率的措施是 ▲ 。
A.适当升高温度
B.适当增大吸收塔内的压强
C.增大空气中O2的浓度
D.吸收塔内填充瓷环,增大气液接触面
⑵在2L密闭容器内充入0.50mol NO和0.25 mol O2,维持反应温度为800℃,当反应达到平衡时,NO的转化率为50%。则800℃时反应2NO+O2=2NO2的平衡常数K= ▲ 。
⑶某工厂每套设备每小时可生产20 t 63%的硝酸(密度为1.4 g/cm3)。假设工业生产硝酸过程中,通过循环操作可以使NH3、O2得以完全利用。
回答下列问题:
①该工厂设备所生产硝酸的物质的量浓度是 ▲ 。
②每小时从吸收塔淋下的水的质量应是多少吨?(写出计算过程)
查看答案和解析>>
科目:高中化学 来源:2011届江苏省扬州中学高三下学期开学练习化学试卷 题型:填空题
右图为工业制备硝酸的设备示意图,其生产过程中发生的反应主要有: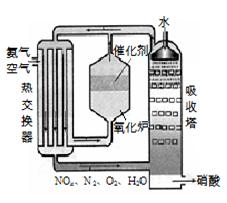
①4NH3(g)+5O2(g) 4NO(g) +6H2O(l) △H<0
4NO(g) +6H2O(l) △H<0
②2NO(g)+O2 (g) 2NO2(g) △H<0
2NO2(g) △H<0
③3NO2(g)+H2O(l) 2HNO3(l) +NO(g) △H<0
2HNO3(l) +NO(g) △H<0
⑴能使吸收塔内反应速率增大,且能提高HNO3产率的措施是 ▲ 。
| A.适当升高温度 |
| B.适当增大吸收塔内的压强 |
| C.增大空气中O2的浓度 |
| D.吸收塔内填充瓷环,增大气液接触面 |
 m3)。假设工业生产硝酸过程中,通过循环操作可以使NH3、O2得以完全利用。
m3)。假设工业生产硝酸过程中,通过循环操作可以使NH3、O2得以完全利用。查看答案和解析>>
科目:高中化学 来源:2010-2011学年江苏省高三上学期期中考试化学卷 题型:填空题
下图为工业制备硝酸的设备示意图,其生产过程中发生的反应主要有:
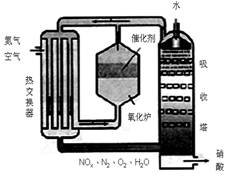
①4NH3(g)+5O2(g) 4NO(g)+6H2O(l) △H<0
4NO(g)+6H2O(l) △H<0
②2NO(g)+O2
(g) 2NO2(g) △H<0
2NO2(g) △H<0
③3NO2(g)+H2O(l) 2HNO3(l) +NO(g) △H<0
2HNO3(l) +NO(g) △H<0
(1)能使吸收塔内反应速率增大,且能提高HNO3产率的措施是 。
A.适当升高温度 B.适当增大吸收塔内的压强
C.增大空气中O2的浓度 D.吸收塔内填充瓷环,增大气液接触面
(2)在2L密闭容器内充入0.50 mol NO和0.25 mol O2,维持反应温度为800℃,当反应达到平衡时,NO的转化率为50%。则800℃时反应2NO+O2=2NO2的平衡常数K= 。
(3)某工厂每套设备每小时可生产20 t 63%的硝酸(密度为1.4 g/cm3)。假设工业生产硝酸过程中,通过循环操作可以使NH3、O2得以完全利用。
回答下列问题:
①该工厂设备所生产硝酸的物质的量浓度是 。
②每小时从吸收塔淋下的水的质量应是多少吨?
查看答案和解析>>
科目:高中化学 来源:2010-2011学年江苏省高三下学期开学练习化学试卷 题型:填空题
右图为工业制备硝酸的设备示意图,其生产过程中发生的反应主要有:

①4NH3(g)+5O2(g) 4NO(g)
+6H2O(l) △H<0
4NO(g)
+6H2O(l) △H<0
②2NO(g)+O2
(g) 2NO2(g)
△H<0
2NO2(g)
△H<0
③3NO2(g)+H2O(l) 2HNO3(l)
+NO(g) △H<0[来源:Zxxk.Com]
2HNO3(l)
+NO(g) △H<0[来源:Zxxk.Com]
⑴能使吸收塔内反应速率增大,且能提高HNO3产率的措施是 ▲ 。
A.适当升高温度
B.适当增大吸收塔内的压强
C.增大空气中O2的浓度
D.吸收塔内填充瓷环,增大气液接触面
⑵在2L密闭容器内充入0.50 mol NO和0.25 mol O2,维持反应温度为800℃,当反应达到平衡时,NO的转化率为50%。则800℃时反应2NO+O2=2NO2的平衡常数K= ▲ 。
⑶某工厂每套设备每小时可生产20 t 63%的硝酸(密度为1.4 g/cm3)。假设工业生产硝酸过程中,通过循环操作可以使NH3、O2得以完全利用。
回答下列问题:
①该工厂设备所生产硝酸的物质的量浓度是 ▲ 。
②每小时从吸收塔淋下的水的质量应是多少吨?(写出计算过程)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com