

分析 SiO2和盐酸不反应,Fe2O3和氢氧化钠不反应而氧化铝能,该工艺流程原理为:铝土矿加盐酸,得到滤液A中含有铝离子、铁离子,沉淀1为二氧化硅,A溶液加入过量氢氧化钠溶液,除去铁离子,将铝离子转化为偏铝酸根,进入滤液B中,通入二氧化碳,将偏铝酸根转化为氢氧化铝沉淀,加热分解得氧化铝,电解氧化铝得到铝,
(1)依据一定物质的量浓度溶液的配制方法以及仪器的选择回答即可;
(2)增大反应物的接触面、升高温度、提高反应物浓度等都可以提高反应速率,据此答题;
(3)铝土矿可以看做Fe2O3、Al2O3、SiO2组成,铝土矿加过量盐酸溶解后,Fe2O3、Al2O3和HCl反应溶解,而SiO2和HCl不反应,不能溶解,不溶物为SiO2;
(4)沉淀2为加入烧碱后的沉淀,所以沉淀为氢氧化物;
(5)NaHCO3可作发酵粉或制纯碱;
(6)根据电解原理可知电解Al2O3制备Al时阴极生成Al,阳极生成O2.
解答 解:SiO2和盐酸不反应,Fe2O3和氢氧化钠不反应而氧化铝能,该工艺流程原理为:铝土矿加入盐酸,得到滤液A中含有铝离子、铁离子,沉淀1为二氧化硅,A溶液加入过量氢氧化钠溶液,除去铁离子,将铝离子转化为偏铝酸根,进入滤液B中,通入二氧化碳,将偏铝酸根转化为氢氧化铝沉淀,加热分解得氧化铝,电解氧化铝得到铝,
(1)在实验中需用1mol•L-1的NaOH溶液480mL,但是实验室中无480mL的容量瓶,依据“大而近”的仪器选择原则,故应选取500mL容量瓶,配制该溶液需要溶解固体,故还需要烧杯,
故答案为:500mL容量瓶;
(2)增大反应物的接触面、升高温度、提高反应物浓度等都可以提高反应速率,所以要加快溶解速率和提高浸出率可以适当升温、充分搅拌、延长溶解时间等,
故答案为:适当升温、充分搅拌、延长溶解时间等;
(3)铝土矿加过量盐酸溶解,Fe2O3、Al2O3和HCl反应溶解,反应方程式分别为:Fe2O3+6HCl=2FeCl3+3H2O,Al2O3+6HCl=2AlCl3+3H2O.而SiO2不与盐酸反应,所以沉淀B为不溶物SiO2,
故答案为:SiO2;
(4)滤液A中含有的阳离子有Fe3+、Al3+、H+,加入过量烧碱,氢离子和氢氧化钠反应生成水,铁离子和铝离子都和氢氧化钠反应生成氢氧化物沉淀,氢氧化铝易溶于氢氧化钠溶液中生成偏铝酸根离子,所以沉淀2的成分是氢氧化铁,生成氢氧化铁的反应方程式为:Fe3++3OH-═Fe(OH)3↓,
故答案为:Fe3++3OH-═Fe(OH)3↓;
(5)NaHCO3可作发酵粉或制纯碱,故答案为:作发酵粉或制纯碱;
(6)根据电解原理可知电解Al2O3制备Al时阴极生成Al,阳极生成O2,电解的反应方程式为2Al2O3$\frac{\underline{\;电解\;}}{\;}$4Al+3O2↑,故答案为:2Al2O3$\frac{\underline{\;电解\;}}{\;}$4Al+3O2↑.
点评 本题主要考查了元素化合物中金属铝、铁的性质,解题时不仅需熟知物质间的反应原理,还需灵活运用于实验的设计,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
 苯甲酸是一种重要的化工产品,某学习小组设计方案制备苯甲酸.反应原理如下:
苯甲酸是一种重要的化工产品,某学习小组设计方案制备苯甲酸.反应原理如下: +2KMnO4$\stackrel{△}{→}$
+2KMnO4$\stackrel{△}{→}$ +KOH+2MnO2+H2O
+KOH+2MnO2+H2O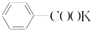 +HCl→
+HCl→ +KCl
+KCl
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 35.5:108 | B. | 16:137 | C. | 8:1 | D. | 108:35.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苏糖能发生银镜反应 | |
| B. | 苏糖与甲酸甲酯含碳的质量分数相同 | |
| C. | 苏糖在一定条件下能发生取代反应 | |
| D. | 苏糖与葡萄糖互为同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 的合成路线如图(部分反应条件省略)
的合成路线如图(部分反应条件省略)
 (注明反应的条件).
(注明反应的条件). .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe3+有氧化性,实验室常用KSCN溶液检验Fe3+ | |
| B. | SO2有较强的还原性,SO2可使酸性KMnO4溶液褪色 | |
| C. | Mg有还原性,电解MgCl2饱和溶液可制备Mg | |
| D. | 浓H2SO4有吸水性,浓H2SO4可使蔗糖炭化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 用装置甲制取二氧化硫气体 | |
| B. | 用装置乙收集二氧化硫气体 | |
| C. | 用适量CuO粉末中和反应后溶液,用装置丙过滤 | |
| D. | 用装置丁蒸发浓缩CuSO4溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com