


科目:高中化学 来源: 题型:
| A、NaOH溶液 |
| B、硫酸溶液 |
| C、NaCN溶液 |
| D、盐酸溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 氮元素是重要的非金属元素,可形成卤化物、氮化物,叠氮化物及配合物等多种化合物.
氮元素是重要的非金属元素,可形成卤化物、氮化物,叠氮化物及配合物等多种化合物.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
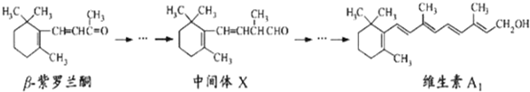
| A、β-紫罗兰酮可使酸性KMnO4溶液褪色 |
| B、1mol中间体X最多能与2molH2发生加成反应 |
| C、维生素A1难溶于水 |
| D、β-紫罗兰酮与中间体X互为同分异构体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com