
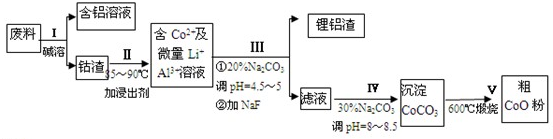
分析 (1)铝和氢氧化钠反应生成偏铝酸钠和氢气,注意该反应中水是反应物;
(2)Co3O4和硫代硫酸根离子在酸性条件下发生氧化还原反应生成硫酸根离子、二价钴离子和水;盐酸具有还原性,能被Co2O3•CoO氧化生成有毒的氯气;
(3)根据铝离子能与碳酸根离子发生双水解生成氢氧化铝和二氧化碳;
(4)碳酸钠溶液在过程Ⅲ中铝离子能与碳酸根离子发生双水解生成氢氧化铝和二氧化碳;碳酸钠溶液在过程Ⅳ中调整pH,提供CO32-,使Co2+沉淀为CoCO3;
(5)碳酸钠是强碱弱酸盐,其溶液呈碱性,碳酸氢钠中HCO3-水解程度大于电离程度,导致碳酸氢钠溶液呈碱性,所以该物质溶于水得稀溶液呈碱性,溶液中存在电荷守恒、物料守恒;
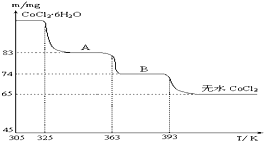
(6)根据关系式CoCl2•6H2O~CoCl2求出CoCl2•6H2O的质量,然后再根据差量法求出B物质的化学式.
解答 解:(1)铝和氢氧化钠溶液反应生成偏铝酸钠和氢气,反应的离子反应方程式为:2Al+2OH-+2H2O=+2AlO2-+3H2↑,
故答案为:2Al+2OH-+2H2O=+2AlO2-+3H2↑;
(2)Co3O4和Na2S2O3在酸性条件下发生氧化还原反应生成CoSO4、Na2SO4和H2O,反应方程式为:4Co3O4+Na2S2O3+11H2SO4=12CoSO4+Na2SO4+11H2O;盐酸具有还原性,能被Co2O3•CoO氧化生成有毒的氯气而污染环境,所以不能盐酸,
故答案为:4Co3O4+Na2S2O3+11H2SO4=12CoSO4+Na2SO4+11H2O;Co2O3•CoO可氧化盐酸产生Cl2污染环境;
(3)铝离子能与碳酸根离子发生双水解生成氢氧化铝和二氧化碳,水解的离子方程式为:2Al3++3CO32-+3H2O=2Al(OH)3↓+3CO2↑;
故答案为:2Al3++3CO32-+3H2O=2Al(OH)3↓+3CO2↑;
(4)碳酸钠溶液在过程Ⅲ中铝离子能与碳酸根离子发生双水解生成氢氧化铝和二氧化碳;碳酸钠溶液在过程Ⅳ中调整pH,提供CO32-,使Co2+沉淀为CoCO3;
故答案为:调整pH,提供CO32-,使Co2+沉淀为CoCO3;
(5)碳酸钠是强碱弱酸盐,其溶液呈碱性,碳酸氢钠中HCO3-水解程度大于电离程度,导致碳酸氢钠溶液呈碱性,所以该物质溶于水得稀溶液呈碱性,各种离子的浓度由大到小顺序为c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+),
故答案为:c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+);
(6 )CoCl2•6H2O~CoCl2
238 130
m 65mg
$\frac{238}{m}=\frac{130}{65mg}$,解得:m=119mg
A物质的化学式为CoCl2•nH2O,则有:
CoCl2•6H2O~CoCl2•nH2O△m
238 18(6-n)
119mg 119mg-74mg
$\frac{238}{119mg}=\frac{18(6-n)}{119mg-74mg}$,解得:n=1,
所以A物质的化学式为:CoCl2•H2O,
故答案为:CoCl2•H2O.
点评 本题考查了金属及其化合物的性质,考查氧化还原反应、离子反应、关系式计算等,难度中等,关键根据实验流程利用氧化还原反应判断发生的离子反应,是对学生综合能力的考查,是一道不错的能力考查题.


 每课必练系列答案
每课必练系列答案科目:高中化学 来源: 题型:解答题
 结合下表回答下列问题(均为25℃时的数据)
结合下表回答下列问题(均为25℃时的数据)| 酸 | 电离平衡常数(Ka) | 酸 | 电离平衡常数(Ka) |
| CH3COOH | 1.7×10-5 | H3BO3 | 5.8×10-10 |
| H2CO3 | Ka1=4.2×10-7 Ka2=5.6×10-11 | HNO2 | 7.1×10-4 |
| HCN | 6.2×10-10 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(H+ )=1.0×10-13mol/L溶液:C6H5O-、K+、SO42-、Br- | |
| B. | 能使紫色石蕊变红的溶液中:NO3-、I-、Ba2+、AlO2- | |
| C. | pH=2的溶液中:Na+、S2-、HCO3-、Ca2+ | |
| D. | 能与金属铝反应放出氢气的溶液:K+ NO3- SO42- NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 有机物 属于芳香烃,含有两种官能团 属于芳香烃,含有两种官能团 | |
| B. | 按系统命名法,化合物 的名称为2,3,6三甲基5乙基庚烷 的名称为2,3,6三甲基5乙基庚烷 | |
| C. |  既属于醇类又属于羧酸 既属于醇类又属于羧酸 | |
| D. | 2甲基3丁烯的命名错误原因是选错了主链 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO42- | B. | NO3- | C. | SCN- | D. | CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③④ | B. | ①③ | C. | ②④⑥ | D. | ②⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实 验 操 作 | 现 象 | 实 验 结 论 | |
| A | 向某溶液中加入硝酸酸化的氯化钡溶液 | 生成白色沉淀 | 溶液中一定含有SO42- |
| B | 将某溶液蘸取少量放置于火焰上灼烧 | 火焰呈黄色 | 该溶液中一定含K+ |
| C | 往某溶液中加入KSCN溶液 | 显血红色 | 溶液中一定含有Fe3+ |
| D | 往某溶液中加入盐酸 | 产生无色气体 | 溶液中一定含有CO32- |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com