

| A. | 金刚烷的分子式是C10H16 | |
| B. | X的一种同分异构体是芳香族化合物 | |
| C. | 上述反应都属于取代反应 | |
| D. | 金刚烷胺的一溴代物有四种 |
科目:高中化学 来源: 题型:选择题
| A. | ①和②产物的阴阳离子个数比不相等 | |
| B. | ①和②生成等物质的量的产物,转移电子数不同 | |
| C. | 25℃、101kPa下Na2O(s)+O2(g)═2Na2O2(s)△H=-142kJ/mol | |
| D. | 25℃、101kPa下Na2O2(s)+2Na(g)═2Na2O(s)△H=-317kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入KSCN溶液不一定变红色 | B. | 溶液中一定含Cu2+ | ||
| C. | 溶液中一定不含Fe3+ | D. | 剩余固体中一定是Fe |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含1molFeCl3的饱和溶液滴入沸水中得到胶体数目为NA | |
| B. | 在标准状况下,22.4LCl2和HCl的混合气体中含有的分子总数为2×6.02×1023 | |
| C. | 常温常压下,7.8gNa2S固体和7.8gNa2O2固体中含有的阴离子数目均为0.1NA | |
| D. | 标准状况下,Na2O2与足量的CO2反应生成2.24LO2,转移电子数为0.4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
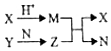 短周期元素A、B、C、D的原子序数依次增大,B和D同主族;X、Y、N分别是由以上四种元素中的两种组成的化合物,Z是由以上三种元素组成的化合物;若X与Y摩尔质量相同,Y为淡黄色固体,上述物质之间的转化关系如图所示(部分生成物省略),则下列说法中一定正确的是( )
短周期元素A、B、C、D的原子序数依次增大,B和D同主族;X、Y、N分别是由以上四种元素中的两种组成的化合物,Z是由以上三种元素组成的化合物;若X与Y摩尔质量相同,Y为淡黄色固体,上述物质之间的转化关系如图所示(部分生成物省略),则下列说法中一定正确的是( )| A. | 相对分子质量M>N,沸点N>M | B. | 原子半径:D>B>C>A | ||
| C. | Z为Na2CO3 | D. | 图中有两个氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
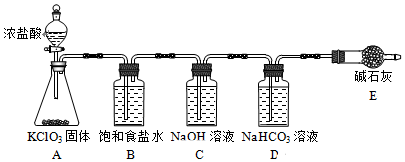
| 实验步骤 | 实验现象 | ||
| B瓶 | C瓶 | D瓶 | |
| 实验1:取样,滴加紫色石蕊溶液 | 变红,不褪色 | 变蓝,不褪色 | 立即褪色 |
| 实验2:取样,测定溶液的pH | 3 | 12 | 7 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com