
���� ��1����������һ��Ԫ����ɵĴ������������ָֻ��������Ԫ�أ�������һ��Ԫ������Ԫ�صĻ�����������������ȫ���������������ڼ����ָһ��������ӻ�笠�������������ӻ�ǽ������ӽ�ϵĻ����
��2�����ݳ������ʵ��ܽ��Խ�ɣ�
��3�����ݳ������ʵ�״̬������
��� �⣺��̼���������Σ���������ˮ��������Ϊ����״̬��
�����������ڽ������������ˮ�����������ƣ�������Ϊ����״̬��
�۶����������ڷǽ��������������ˮ���������ǹ��壻
�����ǽ������ʣ�������ˮ���������ǹ��壻
�������Ƿǽ������ʣ�������ˮ�������������壻
�����������Ǽ����ˮ���������ǹ��壻
�����������ᣬ����ˮ����������Һ�壬
�ʴ�Ϊ����1���ܢݣ��ڢۣ��ޣ��٣���2���٢ڢߣ��ۢܢݣ��ޣ���3���٢ڢۢܢޣ��ߣ��ݣ�
���� ���⿼���˵���ʵĸ�����ʵķ��࣬��Ŀ�ѶȲ���ע�����պõ���ʺͷǵ���ʵĸ�����ʵķ������ݣ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
| A�� | �ɡ�Cl2+H2O�THCl+HClO�����Ƴ���Br2+H2O�THBr+HBrO��Ҳ�ܷ��� | |
| B�� | Na��ˮ��Ӧ����NaOH��H2�������м������ˮ��Ӧ�������ɶ�Ӧ�ļ��H2 | |
| C�� | HCl��ˮ��Һ��ǿ�ᣬ�Ƴ�HF��ˮ��ҺҲ��ǿ�� | |
| D�� | �ɡ�2Fe+3Cl2�T2FeCl3����Ӧ���Ƴ���2Fe+3I2�T2FeI3����ӦҲ�ܷ��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 75% | B�� | 25% | C�� | 50% | D�� | 45% |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
| A�� | H2SO4•H2O | B�� | H2SO4•SO3 | C�� | H2SO4•$\frac{1}{9}$H2O | D�� | SO3•$\frac{10}{9}$H2O |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
| A�� | NO | B�� | CO | C�� | NO2 | D�� | CO2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
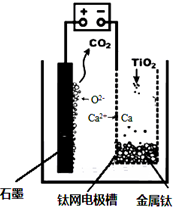 ��ҵ�����������ѵķ����࣮ܶ����������Ҫ�ɷ�FeTiO3������������Ϊ��Ҫԭ��ұ�������ѣ������Ĺ�������ͼ��ͼ��������������Ũ���ᷢ����Ӧ�Ļ�ѧ����ʽΪ��FeTiO3+2H2SO4=TiOSO4+FeSO4+2H2O
��ҵ�����������ѵķ����࣮ܶ����������Ҫ�ɷ�FeTiO3������������Ϊ��Ҫԭ��ұ�������ѣ������Ĺ�������ͼ��ͼ��������������Ũ���ᷢ����Ӧ�Ļ�ѧ����ʽΪ��FeTiO3+2H2SO4=TiOSO4+FeSO4+2H2O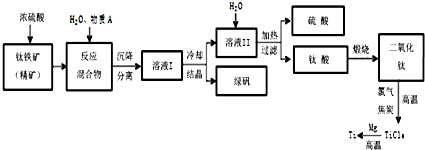
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com