
| A. | 1s22s22p63s23p64s2 | B. | 1s22s22p63s23p3 | ||
| C. | 1s22s22p63s23p2 | D. | 1s22s22p4 |
分析 不同元素的原子在分子内吸引电子的能力大小可用数值表示,该数值称为电负性,即元素的非金属性越强其电负性越大.同一周期中,电负性随着原子序数的增大而增大,同一主族中,元素的电负性随着原子序数的增大而减小,据此分析解答.
解答 解:不同元素的原子在分子内吸引电子的能力大小可用数值表示,该数值称为电负性,元素的非金属性越强其电负性越大.同一周期中,电负性随着原子序数的增大而增大,同一主族中,元素的电负性随着原子序数的增大而减小.
A.质子数为20,是Ca元素,
B.质子数为15,是P元素,
C.质子数为14,是Si元素,
D.质子数为8,是O元素,
所以非金属性最强的元素是O元素,即电负性最强的元素是O元素,
故选D.
点评 本题考查结构位置性质关系、电负性等,题目难度不大,根据核外电子排布式判断元素,掌握电负性的意义与强弱判断是解答本题的关键.


 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案科目:高中化学 来源: 题型:解答题
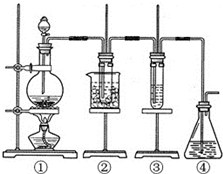 某学习小组设计了如图所示的实验方案来制取次氯酸钠和探究氯水的性质.图中:
某学习小组设计了如图所示的实验方案来制取次氯酸钠和探究氯水的性质.图中:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | KOH比NaOH碱性强 | |
| B. | H3BO3的酸性比H2CO3的酸性强 | |
| C. | HCl、H2S、H3P的还原性性逐渐减弱 | |
| D. | 若M+和R2-的核外电子层结构相同,则离子半径M+>R2- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| A元素的核外电子数和电子层数相等,也是宇宙中最丰富的元素 |
| B元素原子的核外p电子数比s电子数少1 |
| C原子的第一至第四电离能分别是: I1=738kJ/mol I2=1451kJ/mol I3=7733kJ/mol I4=10540kJ/mol |
| D原子核外所有p轨道全满或半满 |
| E元素的主族序数与周期数的差为4 |
| F是前四周期中电负性最小的元素 |
| G在周期表的第七列 |
 .
.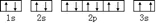 该同学所画的电子排布图违背了泡利原理.
该同学所画的电子排布图违背了泡利原理.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
. .羰基硫(COS)分子结构与AB2分子结构相似,所有原子的最外层都满足8电子结构.用电子式表示羰基硫分子
.羰基硫(COS)分子结构与AB2分子结构相似,所有原子的最外层都满足8电子结构.用电子式表示羰基硫分子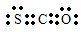 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
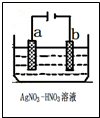 金属冶炼和处理常涉及氧化还原反应.
金属冶炼和处理常涉及氧化还原反应.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
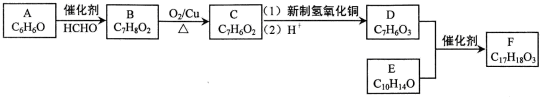
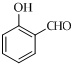 +O2$→_{△}^{Cu}$2
+O2$→_{△}^{Cu}$2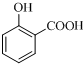 ;
;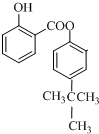 ;
;查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com