
试比较下列金属熔点的高低。
(1)Na Mg Al
(2)Li Na K Rb Cs
科目:高中化学 来源: 题型:
氮化硼很难熔化,加热至3000℃方可汽化。下列对氮化硼的叙述,不正确的是( )
A.氮化硼不是分子晶体B.氮化硼是原子晶体
C.氮化硼是离子晶体D.化学式为BN
查看答案和解析>>
科目:高中化学 来源: 题型:
金属晶体的形成是因为晶体中存在( )
A.金属阴离子间的相互作用
B.金属原子间的相互作用
C.金属阳离子与自由电子间的相互作用
D.金属原子与自由电子间的相互作用
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各物质中,按熔点由高到低的顺序排列正确的是( )
A.CH4>SiH4>GeH4>SnH4
B.KCl>NaCl>MgCl2>MgO
C.Rb>K>Na>Li
D.金刚石>SiO2>NaCl>钠
查看答案和解析>>
科目:高中化学 来源: 题型:
已知A、B、C、D、E、F都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E<F。其中A原子核外有三个未成对电子;化合物B2E的晶体为离子晶体,E原子核外的M层中只有两个成对电子;C元素是地壳中含量最高的金属元素;D单质的晶体类型在同周期的单质中没有相同的;F原子核外最外层电子数与B相同,其余各层电子均充满。
请根据以上信息,回答下列问题(答题时,A、B、C、D、E、F用所对应的元素符号表示):
(1)A、B、C、D的第一电离能由小到大的顺序为______________________。
(2)B的氯化物的熔点比D的氯化物的熔点________(填“高”或“低”),理由是
________________________________________________________________________
________________________________________________________________________。
(3)F的核外电子排布式是______________________________,F的高价离子与A的简单氢化物形成的配离子的化学式为__________。
(4)A、F形成某种化合物的晶胞结构如下图所示(其中A显-3价),则其化学式为
____________。(每个球均表示1个原子)
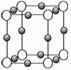
(5)A、C形成的化合物具有高沸点和高硬度,是一种新型无机非金属材料,则其化学式为____________________,其晶体中所含的化学键类型为________________,其晶体类型是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下面有关金属的叙述正确的是( )
A.金属受外力作用时常常发生变形而不易折断,是由于金属离子之间有较强的作用
B.通常情况下,金属中的自由电子会发生定向移动,而形成电流
C.金属是借助金属离子的运动,把能量从温度高的部分传到温度低的部分
D.金属的导电性随温度的升高而降低
查看答案和解析>>
科目:高中化学 来源: 题型:
已知C3N4晶体很可能具有比金刚石更大的硬度,且原子间均以单键结合。下列关于C3N4晶体的说法正确的是( )
A.C3N4是分子晶体
B.C3N4晶体中,C—N键的键长比金刚石中的C—C键的键长要长
C.C3N4晶体中每个C原子连接4个N原子,而每个N原子连接3个C原子
D.C3N4晶体中微粒间通过分子间作用力结合
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述正确的是( )
A.P4和CO2分子中都只含有共价键
B.CCl4和NH3分子的空间结构都是正四面体形
C.BF3分子中各原子均达到8e-稳定结构
D.甲烷的结构式为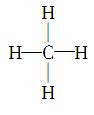 ,它是对称的平面形分子
,它是对称的平面形分子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com